浙江省 诸暨市学勉中学
摘要:化学核心素养是学生具有化学学科特质的关键能力和品格,化学课堂是发展学生化学核心素养的重要过程。以“化学平衡计算”为例,简述发展学生核心素养的探究。
关键词:化学;核心素养 ;化学平衡常数
一、化学核心素养的基本内涵
《教育部关于全面深化课程改革 落实立德树人根本任务的意见》中指出:发展学生核心素养,主要是指学生应具备的,能够适应终身发展和社会发展需要的必备品质和关键能力。从化学学科角度理解这一核心素养指的是在高中化学的教学过程中应当使得学生具有模型认知及证据推理能力,使学生能够将已有的化学知识作为证据进行探究假设,并以此推导出一定的结论,从而使得学生能够在观点、证据及结论之间形成充分的认识。
近年浙江省化学选考试题和模拟试卷中,经常会考查到化学平衡常数的计算问题,其考查形式多样、考查手段灵活。下面主要通过分析化学平衡常数计算中常见的几种类型,追根溯源,让学生构建化学平衡常数计算的思维模型。
1.浓度平衡常数模型
(1)计算模式——“三段式”
如mA(g)+nB(g)![]() pC(g)+qD(g),令A、B起始物质的量浓度分别为amol·L-1、bmol·L-1,达到平衡后消耗A的物质的量浓度为mxmol·L-1,列三段式:
pC(g)+qD(g),令A、B起始物质的量浓度分别为amol·L-1、bmol·L-1,达到平衡后消耗A的物质的量浓度为mxmol·L-1,列三段式:
mA(g)+nB(g)![]() pC(g)+qD(g)
pC(g)+qD(g)
c始/(mol·L-1) a b 0 0
c转/(mol·L-1) mx nx px qx
c平/(mol·L-1) a-mx b-nx px qx
K=
( 2)例1、甲醇是一种重要的化工原料,具有开发和应用的广阔前景。工业上使用水煤气(CO与H2的混合气体)转化成甲醇,反应为CO(g)+2H2(g)
2)例1、甲醇是一种重要的化工原料,具有开发和应用的广阔前景。工业上使用水煤气(CO与H2的混合气体)转化成甲醇,反应为CO(g)+2H2(g) ![]() CH3OH(g)。已知CO的平衡转化率与温度,压强的关系如图所示。在T2℃、P2压强时,往一容积为2L的密闭容器内,充入0.3molCO与0.4molH2发生反应。求此时的浓度平衡常数K=_____;
CH3OH(g)。已知CO的平衡转化率与温度,压强的关系如图所示。在T2℃、P2压强时,往一容积为2L的密闭容器内,充入0.3molCO与0.4molH2发生反应。求此时的浓度平衡常数K=_____;
解析: CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
c始/(mol·L-1) 0.15 0.2 0
c转/(mol·L-1) 0.075 0.15 0.075
c平/(mol·L-1) 0.075 0.05 0.075

=
=400
平衡常数K=
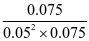
2.连续反应型平衡常数模型
连续反应是指反应物和生成物的化学成分可发生连续变化的一种化学反应。上一个反应的产物是下二个反应的反应物。无论多少个反应,只要在一个体系中,达平衡时计算平衡常数用的都是平衡时的浓度。
例2.在 1 L 真空密闭容器中加入 a mol PH4I 固体,t℃ 时发生如下反应: PH4I (s)![]() PH3(g) + HI (g) ①
PH3(g) + HI (g) ①
4 PH3(g)![]() P4(g)+ 6H2(g)②
P4(g)+ 6H2(g)②
2HI (g)![]() H2 (g) + I2 (g) ③
H2 (g) + I2 (g) ③
达平衡时,体系中 n(HI)= b mol,n(I2)= c mol,n(H2)= d mol,则 t℃时反应①的平衡常数K值为(用字母表示)
解析:面对一个体系多个连续反应,表示反应①的平衡常数 K,需采用逆推法求得 n(PH3),以 n(I2) = c mol推得③生成 n(H2) c mol并消耗 n(HI) 2c mol,则在反应①生成 n(PH3) =n(HI) =(2c+ b) mol,由平衡时 n(H2)= d mol推得反应②生成 n(H2)=(d-c)mol,消耗 n(PH3)=2/3(d-c)mol故①平衡时n(PH3)=2c+ b-2/3(d-c)mol,K=b(b+8c/3-2d/3)
3.竞争反应型平衡常数模型
竞争反应又称平行反应。是指反应物能同时平行地进行两个或两个以上的不同反应,得出不同的产物。其中反应较快或产物在混合物中所占比率较高的称为主反应,其余称为副反应。无论多少个反应,只要在一个体系中,达平衡时计算平衡常数用的都是平衡时的浓度。
例3.丙烯酸是非常重要的化工原料之一,可用甘油催化转化如下:
甘
 油(C3H8O3) 丙烯醛 (C3H4O) 丙烯酸(C3H4O2),
油(C3H8O3) 丙烯醛 (C3H4O) 丙烯酸(C3H4O2),
温度350℃,向1L恒容密闭反应器中加入1.00mol甘油和0.90molO2进行该实验。同时发生副反应:2C3H8O3(g) + O2(g) ![]() 2CO(g) + 2CH3COOH(g) + 2H2O(g)。实验达到平衡时,甘油的转化率为80%。乙酸和丙烯酸的选择性随时间变化如图所示,计算反应2C3H8O3(g) + O2(g)
2CO(g) + 2CH3COOH(g) + 2H2O(g)。实验达到平衡时,甘油的转化率为80%。乙酸和丙烯酸的选择性随时间变化如图所示,计算反应2C3H8O3(g) + O2(g) ![]() 2C3H4O2(g) + 4H2O(g)的平衡常数为_______(X的选择性:指转化的甘油中生成X的百分比)
2C3H4O2(g) + 4H2O(g)的平衡常数为_______(X的选择性:指转化的甘油中生成X的百分比)

解析:在 1L密闭容器中充入1.00mol甘油和0.90molO2,平衡时甘油转化率为80%,丙烯酸的选择性为25%。则丙烯酸的生成量为1mol╳80%╳25%=0.2mol,
则乙酸的生成量为1mol╳80%╳75%=0.6mol
则:2C3H8O3(g) + O2(g) ![]() 2C3H4O2(g) + 4H2O(g)
2C3H4O2(g) + 4H2O(g)
变化量(mol) 0.2 0.1 0.2 0.4
2C3H8O3(g) + O2(g) ![]() 2CO(g) + 2CH3COOH(g) + 2H2O(g)
2CO(g) + 2CH3COOH(g) + 2H2O(g)
变化量(mol) 0.6 0.3 0.6 0.6 0.6
所以平衡时甘油的物质的量为0.2mol, O2为0.5mol,C3H4O2为0.2mol,
H2O为1.0mol。
则平衡常数
这一类型的题目,无论多少个反应,只要在一个体系中,达平衡时计算平衡常数用的都是平衡时的浓度。
总之,复习备考中,针对考题不断变化的求新、求变特征,我们应以不变应万变,紧紧以化学平衡计算“三段式”法为核心,以三种化学平衡常数计算模型为基准,精细研究为手段,加强训练,落实考点,最终突破难点。
当然,核心素养指导下的教学,需要教师更新教学观念,强化学科核心意识。同时,核心素养的培养是个系统、长期的工程,这需要我们不断探索,不断进步。
参考文献:
[1]程遇玲.浅谈高中化学学科核心素养的培养《中学化学教学参考》2017.07
[2]顾建辛.关于化学核心素育的微观思考——原电池教学中的“证据推理与模型认知”《化学教学》2017.11
[3]王程.白旭宁.化学学科核心素养和唯物辩证法的紧密联系《中学化学教学参考》2019.01