张苗宇
济南市历城第一中学 山东省济南市 250115
摘要:本研究基于物质结构教学中实际存在的问题展开,密堆积原理能帮助学生理解金属晶体和离子晶体的构成,对晶体这一章教学起到引领作用。以“原子堆积-空隙模型”为主线,找出这些典型晶体的内在联系,这样设计,更加符合学科逻辑和学生认知逻辑,尊重的知识的连贯性和内在联系。课标要求与高考评价之间本身也有较大差距,使得教师和学生在面对这样的差距会显得无所适从,该教学设计相当于在平时的课堂学习和高考之间架一座桥梁,有助于实现教-学-评一体化设计。
关键词:密堆积原理,原子堆积-空隙模型,学科逻辑,高考评价。
问题提出的背景
自2017年确定山东省作为第二批参加新高考的省份以来,普通高中化学等级考引起了所有高中化学教师的注意。新的课程标准(2017版)旧的教材,取消考试大纲的制定,还增加了选择性必修物质结构与性质,也些猝不及防的变化让经验丰富的老教师都顿时感到荆棘丛生。
教学问题的背景
本人担任2018级高二年级化学教师,由于疫情导致开学延期,而物质结构与性质的第三章晶体结构与性质,是学生通过空中课堂自主学习的。市教育局组织网课的同时,学校也积极安排各年级各学科备课组进行网上备课,根据空中课堂教学内容编制相应的课后检测题,并发布到7天网络平台,每周对学生学习成果进行监测,同时安排任课教师进行在线答疑或录制补充课程。而本节课是在晶体结构与性质的测试后,分析学生学情和学科知识体系,采取相应的教学策略设计而成的。
教学问题的提出
经过7天网络学后测试结果显示,学生在金属晶体和离子晶体晶胞参数等问题上出现了极大的困难,如表格1所示为本人两个班级共81人,在这几类题目上的答对率,和知识点归因。
易错题目 | 答对率 | 知识点归因 |
1.给出不同角度堆积模型,判断面心立方的晶胞 | 38.2% | 不会多角度认识堆积模型 |
2.每个Na+与等距离Na+和Cl-的数目 | 55.6% | 金属晶体与离子晶体联系性差 |
3.CaF2中Ca2+配位数和F-配位数 | 65.4% | 没有建立认识晶体的思维模型 |
4.ZnS中Zn在什么形状的空隙中 | 33.3% | 没有形成空隙这一概念 |
分析空中课堂教学设计及学生思维发展水平,总结如下问题:
由于济南市历城区2018级学生使用人教版(2004版),市直属为鲁科版(2004版),在这部分内容组织顺序上稍有不同。空中课堂为了全面照顾所有学生,又考虑到新版课标(2017版)的要求在晶体密堆积问题上做了弱化处理,测试结果显示学生对密堆积理解得很浅显,学生真的不需要掌握密堆积原理吗?
高中教材中没有涉及密堆积中空隙的具体问题,但是教科书上NaCl晶胞图上确实表示出了氯离子形成的八面体空隙。认识空隙是学习离子晶体的先行知识,这也是学科逻辑的重要体现,而学生普遍认为离子晶体和金属晶体是孤立的,没有必然联系。且2020、2021年高三模拟题中从离子晶体和合金晶体角度出发,试题设问中均涉猎了空隙问题,由于取消了考纲,所以也不存在超纲问题。关于空隙这部分知识,属于大学知识与高中知识衔接出现了问题。
问题研究的理论支撑
学科逻辑——金属密堆积原理的建立过程
1883年,英国学者巴罗发现等径圆球的最密堆积只有两种排列方式:一种是立方对称的,一种是六方对称的。巴罗在1898年发表论文中,还提出用大球和球相间排列形成NaCl型和CsCl型密堆积,并且指出其中大球是按立方最紧密堆积排列的。1913年,布拉格父子在建立X射线晶体学时从巴罗的假说中得到帮助。W.L.布拉格用X射线测定氯化钠和氯化钾的晶体结构,测定结构证实了巴罗假设。测定所得氯化钠晶胞参数的数值,对建立X射线结构分析方法起了重要作用。劳厄、布拉格等人用X射线测定铜和其他金属的晶体结构,也证实了巴罗的等径圆球最密堆积假说。[1]

图1 晶体结构中空隙的地位和作用
学生认知发展——注重结构模型的发展过程和研究方法
学生不但要掌握关于物质微观结构的具体知识,还要认识到这些具体知识是怎么来的,基于哪些证据、经过怎样的推理过程、如何建立结构模型、形成对物质结构及性质的理论解释等[4]。我们也要在教学中,将“证据推理与模型认知”这一核心素养不断外显化,本节课就是认识“A1型密堆积模型”,再从这个化学知识模型上生长出认识一类晶体的思维模型,既面心立方类的离子晶体或者合金晶体。高二学生已具备一定的几何知识和空间想象能力,能将几何思维顺利植入化学课堂,这也符合学生的认知发展要求。
教学设计框架

案例分析
从学科视角看是由等径圆球的A1密堆积演绎出不等径圆球密堆积,也就是金属晶体的堆积演绎出离子晶体的堆积。从教科书视角看明线是先讲金属晶体再到离子晶体,实则埋了一条暗线——“从密堆积到填空隙”。本节课主要就是利用这条暗线,打破原有体系对这块知识进行重组,以适应新高考对学生的要求。
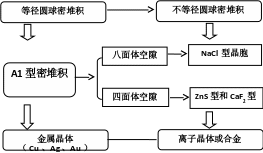
图1 基于“密堆积模型”认识面心立方晶胞的单元教学设计思路
教学案例中重难点的突破(核心教学片段的分析)
[教学片段实录]:
【板块一】任务二:基于密堆积抽取“面心立方晶胞”
【教师】:在认识六方最密堆积模型之后,我们抽取了六棱柱的三分之一作为一个晶胞进行研究。那如何抽取A1最密堆积的晶胞呢?
【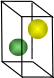 学生】:可以仿照六方的抽取方法。
学生】:可以仿照六方的抽取方法。




图2 学生自制面心立方模型和晶胞的抽取
【教师】迁移的很好。但是晶胞是我们便于研究而人为规定的切割方法。我们已经研究了六方中晶胞,晶胞参数的表示比体心立方复杂多了。有没有更好的切割方法呢?
【学生2】:我们通过制作模型和查阅资料,发现还有一种切割方法。

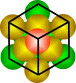

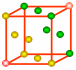

图3 学生自制面心立方模型和晶胞的抽取
【教师】很好,把刚才制作的模型翻转一下变成“5-4-5”的结构就是一个立方体了,请在模型上标出面心的小球。晶胞的选取原则之一是:尽量选择直角数目最多为原则。
[案例分析]:
本片段是让学生用身边的材料,刚性小球乒乓球和太空泥(晾干使用,否则会发生形变影响观察)自己搭建密堆积模型,并从多角度搭建A1密堆积,因为相比体心立方的晶胞和六方的晶胞而言,抽取面心立方晶胞对学生来说是个难点。同时也让学生更清楚一点,晶胞不是晶体真正的结构,而是为了研究晶体我们人为切割和人为规定的,防止学生形成迷思概念。
[教学片段实录]:
【板块二】任务二:找出Cu原子形成的面心立方中空隙种类和个数
活动1:找Cu原子形成的四面体空隙。
【教师】同样,我们动手在学案的密堆积图和面心立方晶胞的图中画出这个紫色中心小球能围成的四面体空隙个数,提示一下大家,从立体几何角度,四面体需要4个小球可以围成。(5分钟后)哪个小组能把他的放在投影仪上展示并讲解一下?
【小组】我们以这个紫色球为研究对象,紫色球可以与上层这三个围成一个正四面体,就是这个黑色的四面体。还可以与两个红球与一个绿色球围成三个红色的四面体,所以紫色与AB层可以围成四个,同样紫色与BC层也能围成四个,共8个四面体空隙。
在晶胞中,我们也画出了8个。
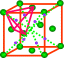
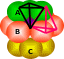

图4 堆积模型和晶胞模型中抽取四面体
【教师】很好,同学们通过制作模型,空间立体感增强了很多,找的也很准确。
活动2:找出Cu原子形成的八面体空隙
【教师】从立体几何角度,八面体需要几个小球能围成啊?(学生:6个)好,大家继续在学案上画八面体,现在密堆积上画,再在晶胞上画。
【小组】我们以紫色球为研究对象,找它与四边形围成的空隙,再延伸出去一个小球,如图所示,就形成了8面体,一共6个。在晶胞中更好找,中间一个完整的,每个棱形形成了四分之一,一共12条棱加起来3个完整的八面体,总共4个八面体。
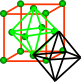


图5 堆积模型和晶胞模型中抽取八面体
【教师】我们总结一下,一个面心立方中有4个Cu原子,可以形成8个四面体空隙和4个八面体空隙。原子数:四面体空隙:八面体空隙=1:2:1。
[案例分析]:
这个任务是本节课的核心任务,通过这一任务的落实,帮助学生建立密堆积和空隙之间的关系。高中结构化学教学中,大多数老师没有这一环节,而缺乏这一环节,学生在之后学习离子晶体就不会把它和金属晶体以及堆积模型联系起来,这样得到的离子晶体知识就像零部件一样拼起来的,只有血肉之躯没有灵魂。
而这部分导学案的编制,也是先呈现了堆积模型的图再呈现晶胞的图,先让学生在堆积模型上找空隙再去晶胞上找空隙,还是帮学生建立一个观念,堆积模型比晶胞更贴近晶体的真实结构,但晶胞能为我们研究提供更多方便。
[教学片段实录]
【板块三】任务二:从填充八面体空隙的角度,确定NaCl晶胞参数
【教师】我们看这个NaCl晶胞,较大的小球是Cl-,单独看氯离子它是哪种密堆积呢?
【学生齐答】面心立方最密堆积。
【教师】距离Cl-最近的Cl-有多少个?
【学生】12个。
【教师】钠离子插的是氯离子形成的什么形状的空隙呢?为什么?
【学生齐答】八面体空隙,因为钠离子在体心和棱上。
【教师】一个Na+周围有多少个与它等距离的Cl-离子呢?为什么?
【学生齐答】6个。因为填充的是6个氯离子围成的八面体空隙。
【教师】所以Na+和Cl-的个数比是1:1,是密堆积球的个数与八面体个数比。

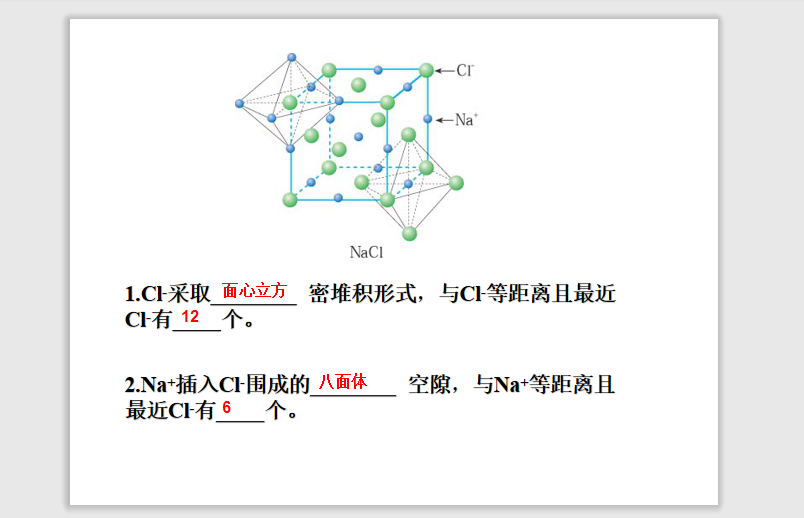
图6. 网络资源ppt 图7. 本节课授课ppt
[案例分析]:
这部分我们首先要明确一点,大多数离子晶体中半径大的是阴离子还是半径小的是阴离子?学生一定会说要看是不是同一周期的,其实大多数阴离子半径都要比阳离子半径要大,比如CaF2,由于阳离子失去电子,它所带正电荷多于负电荷,它的原子核对核外电子的吸引力会更强。所以,认识离子晶体时,我们不妨把阴离子看作等径圆球密堆积,然后阳离子插空隙。以这个角度去设计,学生脑海中就像盖房子一样,先有一个大的钢筋混凝土框架,再去填充砖瓦。如果缺乏这一环节,那么他们所学的知识就像无框架结构的房子很容易坍塌。
图6是网络上主流的高中结构化学教学课件,也是大多数教师采用的版本,也是2019年之前高考题中选做题结构题的主要问法。但我认为就实行新高考之后,在高考题及模拟题中也看不到这类的语言描述。故本节课从图7的角度引导学生认识NaCl晶胞,更贴合现在考试用语,对学生日后从事高等化学的学习有很大帮助。
[教学片段实录]:
【板块四】任务一:从填充四面体空隙的角度,确定立方ZnS晶胞参数
【教师】我们一起观察一下立方ZnS的晶胞,大球是谁?怎么判断出来的?
【学生】S2-,大部分阴离子半径大于阳离子的半径。
【教师】硫离子采取那种密堆积?
【学生】面心立方最密堆积。
【教师】Zn2+插的什么样的空隙呢?插了几个空?
【学生】4个四面体空隙。
【教师】所以Zn2+和S2-的个数比是1:1
【板块四】任务二:从填充四面体空隙的角度,确定立方CaF2晶胞参数(简略)
【教师】我们观察一下CaF2的晶胞,F-插的是什么形状的空隙?
【学生】八个四面体空隙
【教师】所以,CaF2中Ca2+与F-是1:2。


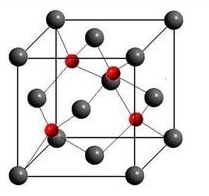

图8 立方ZnS和CaF2的空间结构以及S2-和Ca2+围成的四面体空隙
[案例分析]:
其实在板块三的任务二完成之后,板块四的任务完全可以交由学生自己演绎完成,教师无需再作过多的引导,因为四面体比八面体容易找。而且,此时的学生也能脱离密堆积模型直接从晶胞模型上思考空隙问题了。CaF2的晶胞参数是重点,可以将更多的时间分配到这方面,晶胞参数的解决也为高考中另外一个难点——原子坐标的表示奠定基础。同时,也要列举Li2O这一类反萤石的结构,因为离子晶体中反萤石晶胞结构的更多,而我们其实也是从堆积的角度区别萤石和反萤石结构的。
迁移应用—试题分析
(摘自2021届某地一轮复习检测题片段)
题目表述:(5)如图16-2为一种超导体的面心立方晶胞,C60 分子占据顶点和面心,K+占据的是C60分子围成的_______空隙和______空隙(填几何空间构型);
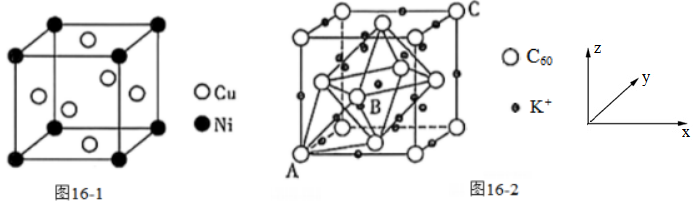
本道题目是该校参与的某次联考中的一道题目的其中一问,通过7天批阅系统可以看出两个班这道题得分率82.1%,明显高于全体受试者(43%)。经过采访不同班级学生,笔者发现,原来很多学生读不懂题目,首先不懂怎么看C60分子围成的空隙,认为是正六面体或者立方体。这就不难知道了,他们的语言体系与考试卷的语言体系有很大出入,进一步说明了本节课的设计思路更符合新高考的命题方向。
(摘自2021届某地一轮复习检测题片段)
题目表述:(5)Fe3O4是由Fe2+、Fe3+、O2-通过离子键而组成的复杂离子晶体。O2-的重复排列方式如图b所示,该排列方式中存在着两种类型的由O2-围成的空隙,如1、3、6、7的O2-围成的空隙和3、6、7、8、9、12的O2-围成的空隙,前者为正四面体空隙,后者为正八面体空隙,Fe3O4中有一半的Fe3+填充在正四面体空隙中,另一半Fe3+和Fe2+填充在正八面体空隙中,则Fe3O4晶体中,正四面体空隙数与O2-数之比为______,其中有_____%正四面体空隙填有Fe3+,有_______%正八面体空隙没有被填充。
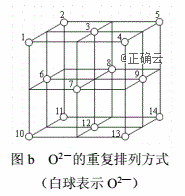
相比上一道题目,难度更大了。首先,学生要很熟悉面心立方中小球:四面体空隙:八面体空隙的值。其次,还要知道Fe3O4种Fe2+和Fe3+的个数比。依据题目可知晶胞中有4个O2-说明只有一个Fe3O4结构基元。那一共一个Fe2+和一个Fe3+,题中说“一半的Fe3+填充在正四面体空隙中”,说明八个四面体空隙只有一个被填充,也就是12.5%被填充了。题目中说“另一半Fe3+和Fe2+填充在正八面体空隙中”,说明四个八面体空隙只有两个被填充,没被填充的就是50%。我们不难感受出,现在高考的出题风向,所以从“堆积-晶胞-空隙-坐标”是要解决的一系列问题串,缺一不可。
结论与思考
本案例是从教学中出现的实际问题出发,经过分析问题产生的原因,以教材为基础,用系统论的方法对教材中“具有某种内在关联性”的内容进行分析、重组、整合并形成相对完整的教学单元,而本节课是其中的课题之一。这样设计,更加符合学科逻辑和学生认知逻辑,尊重的知识的连贯性和内在联系。大多数师生都觉得,现在课本无关重要,课本上讲的考试都不考,根本不相关。经过刚才试题分析,大家也看到了,不是课本学的都不考,而是没有有效的将课本与考试衔接起来,那说明老师的作用至关重要了,我们的教学设计相当要在平时的课堂学习和高考之间架一座桥梁,让学生通过课堂学习更好的完成高考,顺利走进大学校门。
【参考文献】
[1] 麦振洪.X射线衍射的发现及其历史意义[J].科学,2013,(01).
[2] 高剑南.关于密堆积原理[J].化学教学,2009,(10).
[4] 房喻 徐端钧.普通高中化学课程标准(2017版)解读[M].高等教育出版社,2018,9.