兰州生物制品研究所有限责任公司销售部730046,
2兰州生物制品研究所有限责任公司质量保证部730046
摘要:目的 分析A群C群脑膜炎球菌多糖疫苗生产洁净间及检定实验室的湿度变化对疫苗水分含量的影响。方法 根据《中国药典》三部规定的方法对本公司生产的140批 A 群 C 群脑膜炎球菌多糖疫苗的水分含量进行检测,应用 Minitab 数据分析软件对检测结果进行趋势分析、回归分析、方差分析及置信区间分析。结果 水分含量呈现出了明显的季节性变化趋势。实验室湿度比洁净间湿度对疫苗水分含量的影响更大。当实验室湿度、洁净间湿度分别控制在25%、45%以内时,可以很大程度上将疫苗水分含量控制在 2.5% 以内。结论 实验室湿度是影响疫苗水分含量的主要因素,在进行疫苗水分含量检测时应将实验室湿度控制在25%以下。
关键词:A群C群脑膜炎球菌多糖疫苗;水分含量;湿度控制
Effect of airhumidity change on moisture content of group A /C meningococcal polysaccharide vaccine
Lanzhou Institute of Biological Products Co., Ltd., Center for Gansu Provincial Vaccine Engineering Research, Lanzhou 730046,Gansu Province,China
Abstract:Objective To analyze the effect ofair humidity change in the clean room and the laboratory on the moisture content of the group A/ C meningococcal polysaccharide vaccine. MethodsThe moisture content of 140 batches of group A/C meningococcal polysaccharide vaccine produced by our company was tested according to themethod prescribed in Pharmacopoeia of People's Repubic of China(Vol Ⅲ). Performing the trend analysis, regression analysis, analysis of variance and confidence interval analysis of test results using Minitab data analysis software. ResultsThe moisture content showed a clear seasonal trend. Laboratory humidity has a greater impact on vaccine moisture content than clean room humidity.When the humidity in the laboratory and the humidity in the clean room were controlled within 25% and 45%, the moisture content of the vaccine can be controlled within 2.5%. ConclusionLaboratory humidity is a main factor affecting the moisture content of the vaccine, and it should be controlled below 25% when testing the moisture content of the vaccine.
Key words:Group A /C meningococcal polysaccharide vaccine; Moisture content; humidity control
脑膜炎奈瑟菌(N.meningitidis,简称脑膜炎球菌)是细菌性脑膜炎和脑膜炎球菌败血症等侵袭性细菌感染的主要致病菌[1]。自20世纪70年代以来,A群C群脑膜炎球菌多糖疫苗得到广泛应用。多糖疫苗能在免疫成熟者中诱生良好的杀菌抗体应答,可有效用于控制流行和局部爆发,并向一些高危群体提供免疫保护[2-4]。疫苗质量安全社会各界关注的重点,疫苗生产企业及相关业内工作者通过对产品的关键质量指标进行趋势分析,从而在一定程度上对疫苗产品质量加以控制
[5-7]。在世界卫生组(WHO)的批签发指南中,趋势分析结果是批签发的一个重要部分。WHO 对疫苗体系的预认证中,趋势分析也作为批签发中的一个关键项进行评估[8]。
A群C群脑膜炎球菌多糖疫苗的水分含量是产品的关键质量指标,《中国药典》三部(2010及2015版)规定水分含量为 ≤ 3.0%。[9-10]A群C群脑膜炎球菌多糖疫苗的所有生产过程均在符合GMP要求的不同级别的洁净间完成。经冻干封口的成品疫苗在检定实验室进行检测,包括水分含量的检测。因此洁净间湿度和实验室湿度是影响疫苗水分含量的主要因素。杨淼等人进行了A 群C 群脑膜炎球菌多糖疫苗质量的一致性的分析,指出疫苗水分含量呈现出了明显的季节性变化趋势,需要进一步加强洁净间及实验室湿度的控制[7]。
本文应用Minitab 数据分析软件对本公司生产的140批A 群C 群脑膜炎球菌多糖疫苗的水分含量进行趋势分析、回归分析、方差分析及置信区间分析,探讨了洁净间湿度及实验室湿度对疫苗水分含量的影响程度,并提出了建议。现将结果报道如下。
1 材料与方法
1.1 疫苗 A 群C 群脑膜炎球菌多糖疫苗(共140批)由中国生物兰州生物制品研究所有限责任公司提供。
1.2 检测方法 根据《中国药典》三部(2010 及2015版)规定的方法对A 群C 群脑膜炎球菌多糖疫苗的水分含量这一关键质量指标进行检测[9-10]。
1.3 统计学分析 应用Minitab 数据软件对A 群C 群脑膜炎球菌多糖疫苗的水分含量的检测结果进行趋势分析、回归分析、方差分析及置信区间分析,当P < 0. 05 时差异有统计学意义。
2 结果
2.1 洁净间湿度、实验室湿度对疫苗水分含量的影响
疫苗水分含量的变化趋势与室洁净间湿度、实验湿度趋势整体上一致,在11月至次年4月空气湿度偏低阶段疫苗水分结果也相应的变低。疫苗水分含量受洁净间及实验室湿度的影响,且具有季节性影响的特点。见图1。

图1洁净间湿度、实验室湿度及疫苗水分含量趋势图
Fig.1 The trend chart of the clean room humidity, the laboratory humidity and the moisture content of vaccine
2.2疫苗水分含量与洁净间湿度、 实验室湿度的回归分析、方差分析
2.2.1亚批-1、亚批-2分别与洁净间和实验室湿度进行回归分析和方差分析
![]() 为水分含量、
为水分含量、![]() 为洁净间湿度、
为洁净间湿度、![]() 为实验室湿度。
为实验室湿度。
表1亚批-1水分含量与洁净间湿度、实验室湿度的回归分析
Tab.1 Regression analysis of the moisturecontent and theclean room humidity and
the laboratory humidity of Sub-batch-1
自变量 | 系数 | 系数标准误 | T | P | ||
常量 | -1.0075 | 0.1639 | -6.15 | 0.000 | ||
洁净间湿度 | 0.017618 | 0.004567 | 3.86 | 0.000 | ||
实验室湿度 | 0.089016 | 0.008860 | 10.05 | 0.000 | ||
S=0.284208 | R-Sq=73.4% | R-Sq(调整)=73.0% | ||||
表2亚批-1水分含量与洁净间湿度、实验室湿度的方差分析
Tab.2Variance analysis of the moisturecontent and theclean room humidity and
the laboratory humidity of Sub-batch-1
来源 | 自由度 | SS | MS | F | P |
回归 | 2 | 30.121 | 15.061 | 186.45 | 0.000 |
残差误差 | 135 | 10.905 | 0.081 | ||
合计 | 137 | 41.026 | |||
亚批-1水分含量与洁净间和实验室湿度的回归分析,回归方程为 ![]() 。估计系数洁净间湿度和实验室湿度的p 值均为 0.000,即洁净间湿度、实验室湿度与水分含量显著相关,见表1。方差分析表中的p 值为 0.000,表明此回归过程估计的模型在 a 水平为0.05 时具有显著性,见表2。
。估计系数洁净间湿度和实验室湿度的p 值均为 0.000,即洁净间湿度、实验室湿度与水分含量显著相关,见表1。方差分析表中的p 值为 0.000,表明此回归过程估计的模型在 a 水平为0.05 时具有显著性,见表2。
R-Sq指回归模型误差占总误差的百分比,取值在 0% 和 100% 之间,数值越大,表明回归模型越可靠。R-Sq = 73.4%表明洁净间湿度与实验室湿度所带来的误差占水分含量总误差的 73.4%,调整后的 R-Sq 为73.0%。两个值都比较大,表明模型与数据拟合良好。洁净间湿度的回归系数为 0.0176,小于实验室湿度系数 0.0890,因此,实验室湿度对疫苗水分含量的影响程度大于洁净间湿度的影响。见表1。
表3亚批-2水分含量与洁净间湿度、实验室湿度的回归分析
Tab.3Regression analysis of the moisturecontent and theclean room humidity and
the laboratory humidity of Sub-batch-
2
自变量 | 系数 | 系数标准误 | T | P | ||
常量 | -1.3796 | 0.1713 | -8.05 | 0.000 | ||
洁净间湿度 | 0.025067 | 0.004653 | 5.39 | 0.000 | ||
实验室湿度 | 0.085657 | 0.009092 | 9.42 | 0.000 | ||
S=0.297860 | R-Sq=74.4% | R-Sq(调整)=74.0% | ||||
表4亚批-2水分含量与洁净间湿度、实验室湿度的方差分析
Tab.4Variance analysis of the moisturecontent and theclean room humidity and
the laboratory humidity of Sub-batch-2
来源 | 自由度 | SS | MS | F | P |
回归 | 2 | 35.335 | 17.667 | 199.13 | 0.000 |
残差误差 | 137 | 12.155 | 0.089 | ||
合计 | 139 | 47.489 | |||
亚批-2水分含量与实验室湿度和洁净间湿度的回归分析,回归方程为 ![]() 。估计系数洁净间湿度和实验室湿度的p 值均为 0.000,即洁净间湿度、实验室湿度与水分含量显著相关,见表3。方差分析表中的p 值为 0.000,表明此回归过程估计的模型在 a 水平为0.05 时具有显著性,见表4。
。估计系数洁净间湿度和实验室湿度的p 值均为 0.000,即洁净间湿度、实验室湿度与水分含量显著相关,见表3。方差分析表中的p 值为 0.000,表明此回归过程估计的模型在 a 水平为0.05 时具有显著性,见表4。
R-Sq = 74.4% 表明洁净间湿度与实验室湿度所带来的误差占水分含量总误差的74.4% ,调整后的 R-Sq 为74.0%。两个值都比较大,表明模型与数据拟合良好。洁净间湿度的回归系数为 0.0251,小于实验室湿度系数 0.0857,因此,实验室湿度对疫苗水分含量的影响程度大于洁净间湿度的影响。见表3。
2.2.2亚批-1、亚批-2分别与洁净间和实验室湿度进行拟合线图分析

图2亚批-1水分含量与实验室湿度的拟合线图
Fig.2 Fitting line graph of the laboratory humidity and the moisture content of sub-batch-1
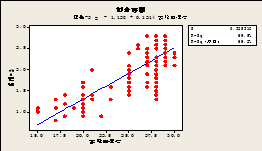
图3亚批-2与实验室湿度的拟合线图
Fig.3 Fitting line graph of the laboratory humidity and the moisturecontent of sub-batch-2

图4 亚批-1与洁净间湿度的拟合线图
Fig.4 Fitting line graph of the clean room humidity and the moisture content of sub-batch-1

图5亚批-2与洁净间湿度的拟合线图
Fig.5 Fitting line graph of the clean room humidity and the moisture content of sub-batch-2
表5拟合线图分析法所得R-Sq值对照表
Tab.5R-Sq value comparison table obtained by the fitting line graph analysis
表5 R-Sq值对照表
实验室湿度与水分含量(亚批-1) | 实验室湿度与水分含量(亚批-2) | 洁净间湿度与水分含量(亚批-1) | 洁净间湿度与水分含量(亚批-2) | |
R-Sq | 70.5% | 69.5% | 53.5% | 57.8% |
R-Sq(调整) | 70.3% | 69.2% | 53.2% | 57.5% |
表5为拟合线图分析法所得R-Sq值对照表,实验室湿度与两个亚批水分含量的R-Sq值及调整后R-Sq值均大于洁净间湿度与两个亚批水分含量的R-Sq值及调整后R-Sq值,即实验室湿度的影响程度要高于洁净间湿度的影响程度。
2.3置信区间法
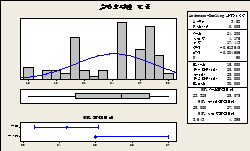
图6 置信区间法分析实验室湿度对疫苗水分含量的影响
Fig.6 The effect of laboratory humidity on the moisture content of vaccine by confidence interval analysis

图7置信区间法分析洁净间湿度对疫苗水分含量的影响
Fig.7 The effect of clean roomhumidity on the moisture content of vaccine by confidence interval analysis
若需要将A群C群脑膜炎球菌多糖疫苗水分含量控制在 2.5 % 以内,对相应的洁净间、实验室的湿度用置信区间法进行分析。当实验室湿度、洁净间湿度分别控制在 23–25 % 、41-45%之内时,有95%的可能性,可以将疫苗水分含量控制在2.5%以内。见图6-7.
2.4讨论
本文对本公司生产的140批 A 群 C 群脑膜炎球菌多糖疫苗的水分含量进行了分析,疫苗水分含量的变化趋势与室洁净间湿度、实验湿度趋势整体上一致,疫苗水分含量受洁净间及实验室湿度的影响,且具有季节性影响的特点。就实验室湿度、洁净间湿度这两个因素而言,实验室湿度对疫苗水分含量的影响程度更大,洁净间湿度的影响程度次之。当实验室湿度、洁净间湿度分别控制在23–25%、41-45%时,可以很好地对疫苗水分含量进行控制。
实验室湿度是影响制品水分结果的主要因素,并且针对单个检测实验室进行湿度控制的可操作性较高,建议在进行该制品水分检测时将检测实验室湿度控制在25%以下;兰州地处西北,全年空气湿度偏低,在洁净间空调系统中并未安装除湿装置,所以暂时不对洁净间进行更为严格的湿度控制。
参考文献
[1]CAMPBELL J D, EDELMAN R, KING J C, et al. Safety, reactogenicity, and immunogenicity of a tetravalent meningococcal polysaccharide–diphtheria toxoid conjugate vaccine given to healthy adults[J]. J INFECT DIS, 2002,186: 1848–1851.
[2]刘胜牙,徐葛林. C群脑膜炎球菌结合疫苗的质量控制与生产的科学挑战.国外医学预防诊断治疗用生物制品分册[J].2004, 27(6): 264-268.
[3]JóDAR L, GRIFFITHS E, FEAVERS I. Scientific challenges for the quality control and production of group C meningococcal conjugate vaccines[J]. Vaccine, 2004, 22: 1047-1053.
[4]TROTTER C, BORROW R, ANDREWS N, et al. Seroprevalence of meningococcal serogroup C bactericidal antibody in England and Wales in the pre-vaccination era[J]. Vaccine, 2003, 21: 1094-1098.
[5]唐静,李亚南,贺鹏飞,等.我国2012 年A 群C 群脑膜炎球菌多糖疫苗质量趋势分析及评价[J]. 中国生物制品学杂志,2014,27(9):1224-1226.
[6]唐静,李亚南,赵丹, 等.我国ACYW135群脑膜炎球菌多糖疫苗趋势分析及质量评价[J].中国生物制品学杂志,2015, 28 (6):657-661.
[7]杨淼,刘东梅,赵阳, 等. 2013~2016 年 A 群 C 群脑膜炎球菌多糖疫苗质量的一致性分析[J]. 中国生物制品学杂志,2017,30(11):1121-1127.
[8]WHO. Guidelines for independent lot release of vaccines by regulatory authorities[S].(2013-10-xx)[2014-12-01]. http// www.who.int /biological/Guidelin-es_for_Lot_Release_AFTER_ECBS_27.1.2011pdf.
[9]Chinese Pharmacopoeia Commission. Pharmacopoeia of People's Repubic of China(VolⅢ)[S]. Beijing:China Med Sci Press,2010:41-43.(in Chinese)
国家药典委员会. 中华人民共和国药典(三部)[S].北京:中国医药科技出版社,2010:41-43.
[10]Chinese Pharmacopoeia Commission. Pharmacopoeia of People's Repubic of China(Vol Ⅲ)[S].Beijing:China Med Sci Press,2015:71-73.(in Chinese)
国家药典委员会. 中华人民共和国药典(三部)[S].北京:中国医药科技出版社,2015:71-73.