1.桂林医学院附属医院a.临床药学与临床药理学教研室,b.药学部,广西 桂林 541001;
2.桂林医学院药学院,广西 桂林 541199
摘要
胶质母细胞瘤(GBM)起源于脑部神经上皮细胞,是一种常见的高度恶性肿瘤。目前常用的治疗方法包括手术切除、放疗和化疗。患者虽然接受了现有的治疗,但是多数患者在诊断后几个月内就导致死亡;所以,目前临床上仍需要进一步的研究发现新的治疗策略来提高患者的生存率。鉴于在多种癌症中取得成功,免疫疗法仍然是近年兴起治疗恶性肿瘤最为有效的方法之一。免疫疗法是通过激活或增强机体的免疫系统来治疗各种疾病的方法。在免疫系统中,白细胞介素21(IL-21),一种主要由CD4+T细胞分泌的I型细胞因子发挥着重要的作用。因为IL-21的低细胞毒性以及参与各种先天性和适应性免疫反应,所以在GBM免疫治疗中IL-21可以作为一个极有潜力的有效靶点。本文主要对IL-21的基本生物学功能、在胶质母细胞瘤肿瘤微环境(TME)中的信号作用及其在GBM免疫治疗中的发展的潜力进行综述。
关键词:胶质母细胞瘤;肿瘤微环境;白细胞介素21;细胞因子;免疫疗法
Research progress of IL-21 in immunotherapy of glioblastoma
Abstract
Glioblastoma (GBM) originates from neuroepithelial cells in the brain and is a common highly malignant tumor. The commonly used treatment methods currently include surgical resection, radiotherapy, and chemotherapy. Although patients have received existing treatment, most of them die within a few months of diagnosis; So, further research is needed to discover new treatment strategies to improve patient survival. Given its success in various cancers, immunotherapy remains one of the most effective methods for treating malignant tumors that have emerged in recent years. Immunotherapy is a method of treating various diseases by activating or enhancing the body's immune system. In the immune system, interleukin-21 (IL-21), a type I cytokine mainly secreted by CD4+T cells, plays an important role. Due to its low cytotoxicity and involvement in various innate and adaptive immune responses, IL-21 can serve as a highly promising and effective target in GBM immunotherapy. This article mainly reviews the basic biological functions of IL-21, its signaling role in the tumor microenvironment (TME) of glioblastoma, and its potential development in GBM immunotherapy.
Keywords: Glioblastoma; Tumor microenvironment; Interleukin-21; Cytokines; Immunotherapy
1、简介
在众多致命疾病中,癌症被认为是世界上发病率和死亡率最高的疾病之一。据报道,癌症是继心血管疾病之后的第二大死亡原因,人类的生命受到严重损害[1,2]。
特别的是,在中枢神经系统(CNS)中,胶质母细胞瘤(Glioblastoma,GBM)是神经胶质瘤的恶性形式,也是成人中最常见和最致命的原发性脑肿瘤[3]。目前,标准的护理治疗仍然以手术切除为中心,并用放疗和替莫唑胺(Temozolomide ,TMZ)化疗来辅助治疗,但是胶质母细胞瘤(GBM)仍然有着较高的发病率和死亡率,所以我们迫切需要新的治疗方法
[4]。实际上,胶质母细胞瘤治疗方法的成功很大程度上受限于血脑屏障(BBB)。尽管血脑屏障对正常中枢神经系统功能至关重要,但在GBM治疗干预过程中,血脑屏障能够限制抗癌药物进入到大脑组织,最终导致治疗失败[5]。因此,降低血脑屏障对一些分子或载体的限制对于开发一种新的疗法至关重要。大脑是一种具有免疫特权的器官,被激活的免疫细胞可以不受限制的进入,从而不会受到血脑屏障的影响[6]。随着人们对GBM背后分子机制的了解和大量可以透过血脑屏障的靶向药物被研究出来,例如免疫治疗药物,为GBM的有效治疗提供了新的方向。目前免疫治疗的主要方法包括免疫检查点抑制剂、溶瘤病毒、治疗性疫苗和CAR - T细胞疗法等[7]。然而,尽管临床前或早期试验显示了免疫检查点抑制剂、病毒治疗、疫苗和CAR - T细胞治疗得到较好的结果,但迄今为止III期研 究的数据尚未证实这些方法有较好的治疗效果[8]。
此外,最新研究的重点是细胞因子在肿瘤免疫疗法中发挥的调节作用,细胞因子是细胞间介质在刺激宿主免疫系统中起关键作用的蛋白质或糖蛋白[9],在GBM免疫治疗中发挥着重要作用。白细胞介素-21(IL-21)已被证明是治疗癌症的有效免疫治疗剂。IL-21可单独用于全身治疗,也可与过继性T细胞、单克隆抗体或肿瘤细胞疫苗联合用于癌症治疗。目前临床上广泛使用IL-2,但大剂量IL-2可对患者肾脏、心脏、神经系统造成严重损害。与相同剂量的IL-2相比,IL-21的毒副作用较小[10]。本文以期为IL-21在GBM免疫治疗中的发展潜力提供科学依据。
2、IL-21的基本生物学功能
作为细胞因子之一的白细胞介素- 21 (IL - 21)是一种多效性细胞因子,由四个α-螺旋束组成,主要由自然杀伤T细胞(NKT)、滤泡辅助T细胞(Tfh)和辅助性T细胞(Th17)产生[11],在先天性和适应性免疫应答中具有多效性作用[12]。IL-21通过刺激CD8+ T细胞和NK细胞的增殖并增加细胞毒性并增强T细胞依赖性B细胞增殖和抗体产生来发挥抗肿瘤活性[13]。在肿瘤微环境(TME)中,IL-21信号可以通过三种不同的途径传递:Janus激酶信号转导和转录激活因子(JAK-STAT)途径、磷酸肌肽3激酶(PI3K)丝氨酸/苏氨酸激酶(AKT)途径和丝裂原活化蛋白激酶(MAPK)途径[14]来增强免疫细胞对GBM的杀伤(图1)。
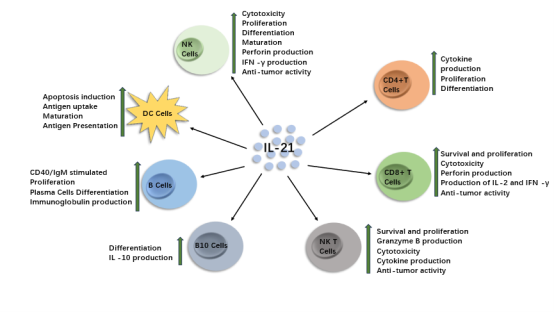
图1 IL-21对多种免疫细胞的影响(根据参考文献[15]修改)
3、胶质母细胞瘤肿瘤微环境
肿瘤微环境(TME)是一个复杂且不断发展的过程[16]。目前,靶向肿瘤微环境成为改善癌症治疗的新方法,因为它以各种方式影响恶性细胞的生长和发展。
GBM细胞的复杂性异质性是由局部炎症性肿瘤微环境促进的,主要诱导肿瘤侵袭性和耐药性。GBM的免疫抑制肿瘤微环境为肿瘤免疫逃逸提供了多种途径。主要表现为:一方面,GBM细胞本身可以分泌各种肿瘤前体细胞因子和趋化因子,这些细胞因子和趋化因子可以影响巨噬细胞极化,促进调节性T细胞(Treg)募集,抑制树突状细胞(DC)成熟和自然杀伤(NK)细胞功能;另一方面,GBM细胞可以表达免疫抑制分子,如程序性细胞死亡蛋白1配体(PD-L1),它可以阻止T细胞增殖和活化[17]。随着对GBM的免疫疗法在临床试验上的研究,其相应的治疗方法也越来越多。例如MinnaSivonen等人的研究,细胞因子组合(IL-2/15、IL-21/15、IL-12/18/15、IL-27/18/15)和激活时间(预激活、再激活、增强或连续)对体外扩增NK细胞的表型、扩增和功能有显著影响,体外针对多种胶质母细胞瘤细胞系[18]。
4、IL-21在GBM肿瘤微环境(TME)中的信号作用
白细胞介素21(IL-21)是I型细胞因子家族中的一员,于2000年首次通过基因组和cDNA测序首次被发现[14,19]。IL-21/IL-21R和γc结合时发挥生物学功能,它们与IL-2、IL-4、IL-7、IL-9和IL-15共享一条γ链[20,21]。由于IL-21R主要在淋巴组织如外周血淋巴细胞、脾脏、淋巴结和骨髓中表达[14],因此IL-21及其受体信号通路主要在免疫系统中发挥生物学作用。
IL-21主要通过激活JAK-STAT信号通路来发挥作用(图2)。JAK1结合IL-21R, JAK3结合γc链, IL-21可被STAT3、STAT1、STAT5激活[22,23]。STAT1在细胞免疫中发挥重要作用,参与细胞生长阻滞和促进细胞凋亡。相反,STAT5促进细胞转化,防止细胞凋亡[24]。STAT3是一种具有强大免疫抑制功能的致癌转录因子,它负责介导肿瘤的生长、分化和凋亡[25]。此外,Rong Zeng等人研究发现 IL-21R的激活可导致其他信号通路的传导,细胞的存活和增殖需要磷酸酰肌醇-3-激酶(PI3K)/蛋白激酶B(AKT)和Ras/Raf丝裂原活化蛋白激酶(MAPK) ERK激酶(MEK)/ MAPK信号通路
[26]。IL-21信号通路在免疫细胞中起着重要作用,它可以刺激和扩增CD8+T细胞、NK细胞和NKT细胞从而增强它们强大的抗肿瘤活性[27]。虽然IL-21在免疫治疗中的应用取得了进展,但其控制和抵抗转移的潜力仍在研究中。理论上,考虑到IL-21对免疫系统,特别是NK和T细胞的影响,它应该能有效地对抗肿瘤细胞的转移。

图2 IL-21信号通路(根据参考文献[11]修改)
5、IL-21在GBM免疫治疗中发展的潜力
在I型细胞因子家族中,白细胞介素-2 (IL-2)是T细胞和NK细胞发育的关键生长因子,该细胞因子被最先用于癌症的免疫治疗。IL-2在癌症治疗中的治疗潜力受到其严重副作用(低血压、心脏毒性、血管渗漏综合征等)的限制是IL-2激活调节性T(Treg)细胞的能力,该细胞通过CTL功能的损害来促进肿瘤生长[28]。白细胞介素-21 (IL-21)是I型家族的另一成员,与IL-2相比,IL-21具有更好的抗肿瘤作用,成为癌症治疗的一个有希望的靶点。2003年G. Wang等[29]首次在小鼠模型中证实IL-21具有显著的抗肿瘤活性,表示其在临床抗癌药物中具有极大治疗潜力。2008年,J.A.Thompson等[30]发表了重组人白细胞介素-21治疗恶性肿瘤的一期研究结果。从机制上说,IL-21不仅能促进CD8+ T细胞和NK细胞的活化和功能,还能限制Tregs反应[31],诱导细胞凋亡[32,33],抑制肿瘤转移[34]。在此基础上,后续研究重点关注IL-21诱导抗肿瘤免疫应答的调控机制,以及IL-21作为免疫调节剂在肿瘤免疫治疗中的作用。
IL-21可以通过影响免疫系统的功能来对抗某些类型的癌症,例如在胶质母细胞瘤免疫治疗中,Sun等人研究了IL-21疫苗病毒联合检查点抑制剂治疗胶质瘤,其通过采用对C57BL/6小鼠进行鞘内和静脉注射IL-21疫苗的治疗方法,激发抗肿瘤免疫,从而影响肿瘤微环境。结果发现IL-21疫苗病毒对小鼠肿瘤生长呈抑制作用[35]。
Tran等人提出了另一种增强免疫系统能力的尝试[36]。他们试图在胶质母细胞瘤小鼠模型中,在用贝伐单抗和伊立替康治疗期间增强NK细胞的作用[36]。在该研究中,免疫系统的增强是通过使用自然杀伤细胞进行的,K562细胞扩增和激活,K562细胞表达配体OX40和与膜相连的IL-18和IL-21[36]。在他们的研究中,K562-OX40L-mb-IL-18/IL-21仅在体外对胶质母细胞瘤表现出细胞毒性作用,而在U87胶质母细胞瘤模型中没有表现出治疗作用。该研究也强调了贝伐单抗和伊立替康复合物的细胞毒性。因此,IL-21被用作佐剂。IL-21像其他白细胞介素一样,在癌症期间发生改变,不仅仅是在大脑中。本实验中使用的抗癌药物不仅巩固了其细胞毒性作用,而且在早期阶段减慢了肿瘤的发展和生长[36]。
Liu等人使用γ链细胞因子IL-2、IL-15和IL-21的组合,首次证明了间皮素作为潜在靶点的免疫学重要性[37]。间皮素是一种40 kDa的肿瘤分化抗原,通常在间皮细胞上表达,但在某些肿瘤中过表达[37]。Liu等人使用γ链细胞因子IL-2、IL-15和IL-21的组合,发现在包括IL-21在内的一些白细胞介素存在下培养的T细胞,显示出间皮素特异性CD4+和CD8+的增殖增强,表明GB患者的免疫细胞可以通过增加细胞因子(IFN-γ、TNF-α)的产生,对通过糖肌醇-磷脂(GPI)结合在细胞表面的成熟间皮素进行识别并产生强烈反应。此外,在含有IL-2/IL-15/IL-21混合物的培养基中,GB患者的T细胞能够显著扩增[38]。
假设这三种白细胞介素能产生有效的免疫应答,Liu等[39] 在接下来的研究中确定NY-ESO-1或survivin表达可能是抗癌定向T细胞治疗的可行靶点。其通过使用包括IL-21在内的一组白细胞介素来评估两种蛋白的表达:Survivin (n = 40个样本)和NY-ESO-1 (n = 38个样本)。发现与II级胶质瘤患者相比,III级胶质瘤患者血液中IFN-γ的产生使T细胞对IL-2/IL-15/IL-2具有较强的反应性。因此,IL-21与IL-15联合使用可防止T细胞凋亡。由于目前还没有针对GB无副作用的最佳治疗方法,因此使用T细胞直接靶向NY-ESO-1,并从健康患者的17个外周血单个核细胞中提取细胞可能是GB治疗的一种创新方法[39]。
其他研究结果也进一步证实免疫疗法是一种有效的抗癌方法。事实上,Wölfl等人表明,在人胶质母细胞瘤样本中,纯化的幼稚CD8+ T细胞与IL-21、IL-7和IL-15等白细胞介素结合,可以引起抗原特异性T细胞的广泛增殖[40]。
在体内原位模型中,主要外周γδT细胞通过IL-21刺激Vγ9Vδ2 T淋巴细胞也能有效消除胶质母细胞瘤细胞
[41]。Joalland等人,研究了免疫刺激因子IL-21对T细胞Vγ9Vδ2体外增敏作用对细胞溶解活性的影响。研究发现IL-21在体外增加了人异体TγδVγ9Vδ2淋巴细胞颗粒酶B的胞内表达和细胞毒性,从而导致原代GB细胞被同种异体TγδVγ9Vδ2细胞通过穿孔蛋白和颗粒酶等酶介导的细胞毒性自然清除。因此,IL-21在体外增加了人异体TγδVγ9Vδ2淋巴细胞颗粒酶B的胞内表达和细胞毒性。直接刺激这些淋巴细胞可以直接增加它们的细胞毒性,避免直接使用这种细胞因子而产生的副作用。
免疫治疗无疑是癌症治疗的最后前沿之一,Daga等人[42]研究了使用转基因IL-21或重组IL-21细胞作为治疗的小鼠胶质瘤原位模型。局部注射IL-21(或重组)诱导了显著的抗肿瘤反应,增强了NK细胞和免疫系统细胞的反应。Daga等人利用IL-21大规模刺激免疫系统的能力。采用生长缓慢的GL261 (GL D2-60)小鼠原位模型。为了克服脑内注射胶质瘤细胞所具有的较差的免疫原性,将相同的肿瘤细胞用含有目标细胞因子的逆转录病毒基因进行转导,从而直接在目标部位提供适当数量的细胞因子。除IL-12外,IL-2对GB细胞具有相似的免疫特性。IL-2和IL-12联合使用显示出有益的叠加效应,使首次植入后的动物存活率为55%,第二次治疗后的总存活率为50%。根据这项工作,IL-21已被证明在诱导持久免疫方面明显优于IL-2,而不会在大脑水平上产生较大的副作用。
尽管IL-21激活和增强免疫系统的理想治疗方法,但目前还没有基于其使用的真正治疗方法;事实上,迄今为止进行的所有研究都没有将IL-21作为主角,而只是作为辅助治疗剂。
6. 结论和未来展望
为了提高GBM治疗的有效性,目前已经开发了许多通过改变免疫系统来进行治疗的新方法。在这一研究领域,细胞因子发挥着重要的作用。其中IL-21将继续被广泛研究,其许多实际应用尚未完全了解。由于IL-21的潜在治疗用途以及其作用机制尚未阐明。此外,使用小鼠模型或者更好的临床试验,是评估IL-21关键作用的一个很好的研究方法。从抗癌的角度来看,激活和增强免疫系统是对抗肿瘤的关键步骤,尤其是在受高度改变的微环境影响很大的类型中,如脑肿瘤。因此,预计未来将产生更多靶向IL-21的治疗性化合物,为胶质母细胞瘤等原发性脑肿瘤的治疗提供创新视角,提高患者的生存率。
参考文献
[1]Alemi F, Zarezadeh R, Sadigh A R, et al. Graphene oxide and reduced graphene oxide: Efficient cargo platforms for cancer theranostics[J]. Journal of Drug Delivery Science and Technology, 2020, 60: 101974.
[2]Augustine S, Singh J, Srivastava M, et al. Recent advances in carbon based nanosystems for cancer theranostics[J]. Biomaterials Science, 2017, 5(5): 901-952.
[3]Russo M N, Whaley L A, Norton E S, et al. Extracellular vesicles in the glioblastoma microenvironment: A diagnostic and therapeutic perspective[J]. Molecular Aspects of Medicine, 2023, 91: 101167.
[4]Gedeon P C, Champion C D, Rhodin K E, et al. Checkpoint inhibitor immunotherapy for glioblastoma: current progress, challenges and future outlook[J]. Expert Review of Clinical Pharmacology, 2020, 13(10): 1147-1158.
[5]Arvanitis C D, Ferraro G B, Jain R K. The blood–brain barrier and blood–tumour barrier in brain tumours and metastases[J]. Nature Reviews Cancer, 2020, 20(1): 26-41.
[6]Wildner G. Antigenic mimicry - The key to autoimmunity in immune privileged organs[J]. Journal of Autoimmunity, 2023, 137: 102942.
[7]Ardizzone A, Basilotta R, Filippone A, et al. Recent Emerging Immunological Treatments for Primary Brain Tumors: Focus on Chemokine-Targeting Immunotherapies[J]. Cells, 2023, 12(6): 841.
[8]Maccari M, Baek C, Caccese M, et al. Present and Future of Immunotherapy in Patients With Glioblastoma: Limitations and Opportunities[J]. The Oncologist, 2023: oyad321.
[9]Fajgenbaum D C, June C H. Cytokine Storm[J]. The New England Journal of Medicine, 2020, 383(23): 2255-2273.
[10]牟春燕, 于峰, 周阳, 等. 白细胞介素21抗肿瘤作用研究进展[J]. 生物学杂志, 2019, 36(2): 73-77.
[11]Spolski R, Leonard W J. Interleukin-21: a double-edged sword with therapeutic potential[J]. Nature Reviews. Drug Discovery, 2014, 13(5): 379-395.
[12]Spolski R, Leonard W J. Interleukin-21: basic biology and implications for cancer and autoimmunity[J]. Annual Review of Immunology, 2008, 26: 57-79.
[13]Liu H, Wang R, An D, et al. An engineered IL-21 with half-life extension enhances anti-tumor immunity as a monotherapy or in combination with PD-1 or TIGIT blockade[J]. International Immunopharmacology, 2021, 101(Pt A): 108307.
[14]Parrish-Novak J, Dillon S R, Nelson A, et al. Interleukin 21 and its receptor are involved in NK cell expansion and regulation of lymphocyte function[J]. Nature, 2000, 408(6808): 57-63.
[15]Xu D H, Zhu Z, Wakefield M R, et al. The role of IL-11 in immunity and cancer[J]. Cancer Letters, 2016, 373(2): 156-163.
[16]Hinshaw D C, Shevde L A. The Tumor Microenvironment Innately Modulates Cancer Progression[J]. Cancer Research, 2019, 79(18): 4557-4566.
[17]Huang B, Li X, Li Y, et al. Current Immunotherapies for Glioblastoma Multiforme[J]. Frontiers in Immunology, 2020, 11: 603911.
[18]Sivonen M, Sirviö K A, Wojciechowski S, et al. Cytokines impact natural killer cell phenotype and functionality against glioblastoma in vitro[J]. Frontiers in Immunology, 2023, 14: 1227064.
[19]Ozaki K, Kikly K, Michalovich D, et al. Cloning of a type I cytokine receptor most related to the IL-2 receptor beta chain[J]. Proceedings of the National Academy of Sciences of the United States of America, 2000, 97(21): 11439-11444.
[20]Burgess S J, Marusina A I, Pathmanathan I, et al. IL-21 down-regulates NKG2D/DAP10 expression on human NK and CD8+ T cells[J]. Journal of Immunology (Baltimore, Md.: 1950), 2006, 176(3): 1490-1497.
[21]Zhou Y, Quan G, Liu Y, et al. The application of Interleukin-2 family cytokines in tumor immunotherapy research[J]. Frontiers in Immunology, 2023, 14: 1090311.
[22]Leonard W J, Spolski R. Interleukin-21: a modulator of lymphoid proliferation, apoptosis and differentiation[J]. Nature Reviews. Immunology, 2005, 5(9): 688-698.
[23]Asao H, Okuyama C, Kumaki S, et al. Cutting edge: the common gamma-chain is an indispensable subunit of the IL-21 receptor complex[J]. Journal of Immunology (Baltimore, Md.: 1950), 2001, 167(1): 1-5.
[24]Bromberg J, Darnell J E. The role of STATs in transcriptional control and their impact on cellular function[J]. Oncogene, 2000, 19(21): 2468-2473.
[25]Yang H, Yamazaki T, Pietrocola F, et al. STAT3 Inhibition Enhances the Therapeutic Efficacy of Immunogenic Chemotherapy by Stimulating Type 1 Interferon Production by Cancer Cells[J]. Cancer Research, 2015, 75(18): 3812-3822.
[26]Zeng R, Spolski R, Casas E, et al. The molecular basis of IL-21-mediated proliferation[J]. Blood, 2007, 109(10): 4135-4142.
[27]Eivary S H A, Kheder R K, Najmaldin S K, et al. Implications of IL-21 in solid tumor therapy[J]. Medical Oncology (Northwood, London, England), 2023, 40(7): 191.
[28]Ramos T L, Bolivar-Wagers S, Jin S, et al. Prevention of acute GVHD using an orthogonal IL-2/IL-2Rβ system to selectively expand regulatory T cells in vivo[J]. Blood, 2023, 141(11): 1337-1352.
[29]Wang G, Tschoi M, Spolski R, et al. In vivo antitumor activity of interleukin 21 mediated by natural killer cells[J]. Cancer Research, 2003, 63(24): 9016-9022.
[30]Schmidt H, Brown J, Mouritzen U, et al. Safety and clinical effect of subcutaneous human interleukin-21 in patients with metastatic melanoma or renal cell carcinoma: a phase I trial[J]. Clinical Cancer Research: An Official Journal of the American Association for Cancer Research, 2010, 16(21): 5312-5319.
[31]Attridge K, Wang C J, Wardzinski L, et al. IL-21 inhibits T cell IL-2 production and impairs Treg homeostasis[J]. Blood, 2012, 119(20): 4656-4664.
[32]Wang J, Li T, Zan H, et al. LUBAC Suppresses IL-21-Induced Apoptosis in CD40-Activated Murine B Cells and Promotes Germinal Center B Cell Survival and the T-Dependent Antibody Response[J]. Frontiers in Immunology, 2021, 12: 658048.
[33]Mehta D S, Wurster A L, Whitters M J, et al. IL-21 induces the apoptosis of resting and activated primary B cells[J]. Journal of Immunology (Baltimore, Md.: 1950), 2003, 170(8): 4111-4118.
[34]Chapuis A G, Lee S M, Thompson J A, et al. Combined IL-21-primed polyclonal CTL plus CTLA4 blockade controls refractory metastatic melanoma in a patient[J]. The Journal of Experimental Medicine, 2016, 213(7): 1133-1139.
[35]Sun Y, Zhang Z, Zhang C, et al. An effective therapeutic regime for treatment of glioma using oncolytic vaccinia virus expressing IL-21 in combination with immune checkpoint inhibition[J]. Molecular Therapy Oncolytics, 2022, 26: 105-119.
[36]Tran T A T, Kim Y H, Duong T H O, et al. Natural killer cell therapy potentially enhances the antitumor effects of bevacizumab plus irinotecan in a glioblastoma mouse model[J]. Frontiers in Immunology, 2022, 13: 1009484.
[37]Liu Z, Rao M, Poiret T, et al. Mesothelin as a novel biomarker and immunotherapeutic target in human glioblastoma[J]. Oncotarget, 2017, 8(46): 80208-80222.
[38]Anton K, Banerjee D, Glod J. Macrophage-associated mesenchymal stem cells assume an activated, migratory, pro-inflammatory phenotype with increased IL-6 and CXCL10 secretion[J]. PloS One, 2012, 7(4): e35036.
[39]Liu Z, Poiret T, Persson O, et al. NY-ESO-1- and survivin-specific T-cell responses in the peripheral blood from patients with glioma[J]. Cancer immunology, immunotherapy: CII, 2018, 67(2): 237-246.
[40]Wölfl M, Merker K, Morbach H, et al. Primed tumor-reactive multifunctional CD62L+ human CD8+ T cells for immunotherapy[J]. Cancer immunology, immunotherapy: CII, 2011, 60(2): 173-186.
[41]Joalland N, Chauvin C, Oliver L, et al. IL-21 Increases the Reactivity of Allogeneic Human Vγ9Vδ2 T Cells Against Primary Glioblastoma Tumors[J]. Journal of Immunotherapy (Hagerstown, Md.: 1997), 2018, 41(5): 224-231.
[42]Daga A, Orengo A M, Gangemi R M R, et al. Glioma immunotherapy by IL-21 gene-modified cells or by recombinant IL-21 involves antibody responses[J]. International Journal of Cancer, 2007, 121(8): 1756-1763.