国家知识产权局专利局专利审查协作广东中心
摘要:我国是一个设施农业大国,其中设施蔬菜规模最大。设施栽培农业在我国蔬菜和其它重要经济作物栽培中发挥了巨大的作用,取得了显著的经济和社会效应利用从次生盐渍化土壤筛选的功能菌株研制土壤修复菌剂,并进行盆栽试验,研究其对次生盐渍化土壤的修复作用。结果表明:筛选的两个功能菌株鉴定为胶冻样类芽孢杆菌和地衣芽孢杆菌,分别对两株菌做了功效评价,发现两株菌都能分泌氮素同化过程所需的关键酶,并通过数据说明菌株在次生盐渍化土壤中转化硝酸盐的途径为同化作用途径。同时,两株功能菌也能分泌胞外多糖,促进土壤团聚体形成。根据盆栽试验结果说明土壤修复菌剂不仅在土壤硝酸盐转化方面具有良好的转化作用,也能改善作物根际环境,降低作物中的硝酸盐含量,提高作物品质。
关键词:次生盐渍化;土壤修复菌剂;同化作用;胞外多糖;硝酸盐转化
我国是一个设施农业大国,其中设施蔬菜规模最大。设施栽培农业在我国蔬菜和其它重要经济作物栽培中发挥了巨大的作用,取得了显著的经济和社会效应[1]。但是随着过量施用化肥,以及设施栽培中的水、肥、气、热等因子的特殊性,与露地有明显的差异,加之复种指数高,施肥、灌溉、耕作频率大,管理技术滞后;设施内得不到自然雨水的淋洗,使土壤理化性质发生变化,逐步形成高度熟化,导致土壤产生次生盐渍化、养分不均衡、土壤板结、土壤酸化等诸多生产问题[2-3]。
传统解决土壤次生盐渍化的途径有很多:灌水洗盐法、土壤改良剂法、半腐熟有机肥法以及种植耐盐植物品种等,这些方法易造成二次污染或降低生产效益,并不能从根本上解决土壤的次生盐渍化问题[4]。与其它方法相比,微生物修复具有以下几点优势:不产生二次污染,不增加周围环境负担,成本低,操作方便[5]。因而生物修复逐渐受到国内外的广泛重视。以微生物为主的生物修复过程,可归结为利用微生物细胞内部的酶系统对污染物进行生物降解反应[6]。为此,本研究开展土壤次生盐渍化的微生物筛选、鉴定、修复研究,以期控制次生盐渍化的危害。
1 材料与方法
1.1 材料
1.1.1 材料采集
选取漳州次生盐渍化污染的设施大棚0~10 cm的表层新鲜土壤。
1.1.2 供试培养基
富集培养基:KNO3 10.0 g,KCl 1.0 g,Fe SO4·7H2O 10.0 mg,Mg SO4·7H2O 0.5g,CaCl2 1.0mg,KH2PO4 0.5g,葡萄糖7.5 g,蒸馏水1000 mL,pH 7.2~7.4,121℃高压蒸汽灭菌20 min。
分离培养基:KNO3 10.0 g,KCl 1.0 g,Fe SO4·7H2O 10.0 mg,MgSO4·7H2O 0.5 g,CaCl2 1.0 mg,KH2PO4 0.5 g,葡萄糖 7.5 g,琼脂 18.0 g,蒸馏水1000 mL,pH 7.0,121 ℃高压蒸汽灭菌20 min,冷却至50-55 ℃时倒平板。
牛肉膏蛋白胨培养基:蛋白胨10 g,牛肉膏3 g,NaCl 5 g,琼脂18.0 g,蒸馏水1 L,pH 7.0-7.4,121 ℃高压蒸汽灭菌20 min,冷却至 50-55 ℃时倒平板。
无机盐培养基:KNO3 3.6 g(NO3- 500 mg/L)、蔗糖13.3 g,其余成分同富集培养基。
1.2 试验方法
1.2.1 菌株分离、纯化
选取漳州次生盐渍化污染的设施大棚0~10 cm的表层新鲜土壤,分别混合,称10.0 g于100 mL富集培养基中,置于28℃、120 r/min条件下震荡培养,每隔一周取样,按10%的接种量转接到新鲜的富集培养基中,如此反复驯化。在分离培养基平板上采用平板划线法对菌种进行纯化,挑取单菌落在牛肉膏培养基上继续划线,直到分离出单菌落,斜面低温保存。
1.2.2 菌株硝态氮转化率测定
将上述6株菌接种于无机盐液体培养基中活化,30℃振荡培养24h后,以5%的接种量接种于无机盐液体培养基中,培养3d后,测定培养基中的硝态氮含量,硝态氮含量采用酚二磺酸比色法(A420nm)测定。不加菌的培养基作为空白对照。
1.2.3 菌种鉴定
将上述2株菌在牛肉膏培养基中做斜面保存,送至农业部做菌种鉴定。
1.2.4 菌株产硝态氮转化相关酶类的测定
取发酵24h的发酵液,4℃冷冻离心机中12000rpm离心15min,去除菌体,取上清液(粗酶液)进行酶活力检测。空白以100 ℃灭活的粗酶液作为对照。
1.2.5 功能菌转化途径研究
取次生盐渍化土壤,每盆装土壤500g,测定原土壤中硝态氮含量,分别取未接种的培养基(空白对照)、离心去除菌体的发酵液、不做任何处理的发酵液,按20%添加量均匀施入土壤。分别测定第0天和第15天土壤硝态氮、总氮含量。土壤硝态氮测定参考GB/T 32737-2016土壤硝态氮的测定(紫外分光光度法),土壤总氮测定参考NY/T 53-1987土壤全氮的测定(半微量凯氏定氮法),全氮测定前需用浓硫酸对风干土样消煮。本实验中的发酵液为两株菌按比例混合而成。
1.2.6 菌株产胞外多糖对土壤结构的影响
细菌胞外多糖的测定,用葡萄糖做标准曲线,采用苯酚-硫酸法检测(OD490)。
为了进一步观察胶冻样类芽孢杆菌和地衣芽孢杆菌所产胞外多糖是否能够促进团聚体形成,本研究设计了以下几组土柱实验。实验土壤采用漳州市芗城区的1~20cm表层盐渍土,将菌液按5%的接种量(菌液浓度用无菌水统一调整为10亿/mL)与土壤搅拌混匀,装入PVC管,用8层灭菌纱布包扎PVC管口,用土壤湿度计监测,控制水分在20%左右。2个月后,采用人工湿筛法筛分土壤(土壤团粒分析仪检测),筛子的振荡频率为40次/min,筛子孔径为2、1、0.5、0.25和0.053mm。将土壤筛分为:直径>2mm大团聚体、2~0.25mm小团聚体、0.25~0.053mm微团聚体和0.053以下的黏砂粒四个级别。
1.2.7 菌剂研制
将原料(菇渣和豆粕粉)和菌液(胶冻样类芽孢杆菌和地衣芽孢杆菌)经过液体发酵和固体发酵后,按比例进行配方调配制成土壤修复菌剂。
1.2.8 盆栽试验
试验于2019年3月10日~9月12日,设在福建省亚热带植物研究所进行试验。试验地概况:试验温室具有避雨、通风、调温的功能,年平均温度在25 ℃左右。
供试植物为油麦菜,试验设四个处理,重复三次,试验处理为:空白对照(CK1)、常规施肥(CK2)、常规施肥+基质(CK3)、常规施肥+土壤修复菌剂。
试验实施及田间管理:选取已发生盐渍化现象的表层土(0-10cm),进行混匀后。油麦菜种子置于培养皿,加水浸泡至露白,将露白的油麦菜种子采用垄沟的方法播种,覆土0.5~1 cm并浇足水获得幼苗,生长良好的油麦菜幼苗(地上部4~6 cm,根部3~4 cm),按照试验方案设计要求,分组移植到相应试验盆中。常规施肥的方法为每千克风干土壤添加0.3 g尿素、0.5 g KH2PO4、0.08 g KCl,基质和土壤修复菌剂分别以土壤质量的5%加入,每盆装土2 kg,每盆定植5~6株。定植后使用盆栽地自带的喷雾装置定期浇水并除草。期间不再进行施肥,但进行定期观察和检测。
检测方法:土壤EC值:采用浸提法,称取20g风干土,加入装有100mL去离子水的三角瓶中,震荡混匀15min,用滤纸过滤的上清液,用电导仪直接读取土壤的EC值。土壤硝态氮:酚二磺酸比色法;土壤有机质含量:重铬酸钾容量法;作物硝酸盐含量:紫外分光光度法。分别在种植1个月、2个月、3个月和6个月后持续监测土壤硝态氮、有机质和EC值。作物的产量和硝酸盐含量则在采收时检测。
2 结果与分析
2.1 菌株分离结果
经过分离、纯化,最终得到6株能利用硝态氮作为氮源的细菌,分别命名为SJ-1、SJ-2、SJ-3、SJ-7、SJ-8和SJ-9,并进行镜检和革兰氏染色,结果见表1。
表1 菌株革兰氏染色结果
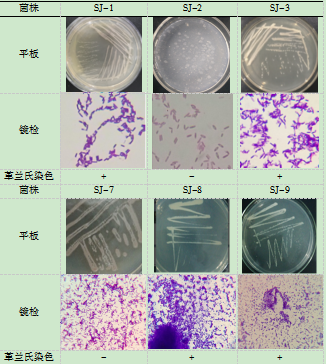
2.2 菌株硝态氮转化率测定结果
根据试验结果可知,SJ-3菌株的硝态氮转化率最高(57%),其次是SJ-2(32%),其余SJ-1、SJ-7、SJ-8和SJ-9转化率分别为12%、5%、3%、9%。选择两株硝酸盐转化率较高的菌株进行后续的研究,即SJ-2和SJ-3。
2.3 菌种鉴定结果
将上述2株菌在牛肉膏培养基中做斜面保存,送至农业部做菌种鉴定,鉴定结果SJ-2和SJ-3分别为胶冻样类芽孢杆菌和地衣芽孢杆菌。
2.4 菌株产硝态氮转化相关酶类的测定
测定结果显示,去除菌体的发酵液中,胶冻样类芽孢杆菌硝酸盐还原酶和亚硝酸盐还原酶活力分别为5.3U/mL和8.9U/mL。地衣芽孢杆菌硝酸盐还原酶和亚硝酸盐还原酶活力分别为8.1U/mL和10.2U/mL。组合菌液的酶活性最高,硝酸盐还原酶和亚硝酸盐还原酶活力分别为10.3U/mL和11.7U/mL。说明组合菌的产酶能力更高。
2.5 功能菌转化途径研究结果
测定结果,加入无菌发酵液和原发酵液15天后,硝态氮含量均有明显降低,空白对照组基本不变,硝态氮减少量表现为空白<无菌发酵液<原发酵液,说明发酵液中菌株的代谢产物可以转化硝态氮,未去除菌体的发酵液随着时间的增加,微生物在土壤中继续繁殖,因此,硝态氮转化率较高。而无论是空白组或无菌发酵液或原发酵液,土壤中的总氮含量在第0天和第15天,均没有显著性差异,说明菌株对硝态氮的转化是通过同化作用,而非反硝化作用,土壤中氮素被转化到微生物体内成为内源氮,从而导致土壤中的全氮含量基本保持不变。
2.6 菌株产胞外多糖对土壤结构的影响
从试验结果看,两株菌都有利于盐渍化板结土壤团聚体的形成,且胶冻样类芽孢杆菌形成团聚体的能力优于地衣芽孢杆菌,两菌组合优于单一菌株作用效果,土壤水稳性团聚体(一般将团聚体分为>0.25mm水稳性团聚体和<0.25mm微团聚体)比空白对照组提高了30.2%。将发酵液施入土壤后测定土壤中的胞外多糖含量发现,胞外多糖含量与土壤团聚体形成呈正相关关系。
2.7 田间试验结果
根据试验结果可知,不同施肥处理对土壤的理化性质均存在显著差异。与空白对照相比,处理4经过6个月的修复,硝态氮含量为256.8mg/kg,其硝态氮转化率为71.3%,而常规施肥的硝态氮含量则略有提高;有机质含量提高13.90%,其次是处理3,提高了10.16%,原因是产品中本身有丰富的有机质;土壤EC值的变化趋势与硝态氮相似,刚施入菌剂时,EC值下降较快,而在后期则下降速率减缓。
作物采收时,对作物的硝酸盐含量和作物单株鲜重进行检测。结果为,施用土壤修复菌剂可有效降低作物体内的硝酸盐含量,硝酸盐含量比对照组(处理1)降低34%;同时施用土壤修复菌剂的作物其长势更好,其鲜重平均比对照组(处理1)增长了21.6%,比常规施肥增产9.1%。
3 总结与讨论
设施栽培蔬菜土壤出现次生盐渍化现象已经普遍存在,目前已经有很多使用微生物来修复土壤的报道,对于使用微生物菌剂来修复次生盐渍化土壤的报道目前还少有报道。本研究从漳州设施蔬菜大棚土壤中分离筛选到6株能以硝酸钾为唯一氮源的菌株,其中SJ-2、SJ-3两株菌对硝态氮转化能力较高,经鉴定,分别为胶冻样类芽孢杆菌和地衣芽孢杆菌,对于胶冻样类芽孢杆菌与地衣芽孢杆菌组合的微生物菌剂用来修复次生盐渍化土壤,目前还鲜有报道,目前报道的大多数是巨大芽孢杆菌等其它芽孢杆菌。
分别对两株菌做了功效评价,发现两株菌都能分泌氮素同化过程所需的关键酶,并通过数据说明菌株在次生盐渍化土壤中转化硝酸盐的途径为同化作用途径。同时,两株功能菌也能分泌胞外多糖,促进土壤团聚体的形成。说明本研究不仅在土壤硝酸盐转化方面具有良好的转化作用,也能改善作物根际环境,降低作物中的硝酸盐含量,提高作物品质。
综合上述结论,说明本研究所得的土壤修复菌剂在重度以下盐渍化土壤中,能通过微生物的硝酸盐同化作用,有效转化土壤中的硝态氮,降低作物的硝酸盐含量,提高作物的食品安全性。同时,产品中的功能菌代谢产生的胞外多糖可以促进土壤水稳性团聚体的形成(>0.25mm),从而改善土壤结构,缓解土壤板结状况。将本产品施入土壤中,还能提高土壤微生物多样性和抗逆性。
参考文献:
[1]唐冬,毛亮,支月娥,等. 上海市郊设施大棚次生盐渍化土壤盐分含量调查及典型对应分析[J]. 环境科学,2020,35(12):4705-4711.
[2]杨真,王宝山. 中国盐渍土资源现状及改良利用对策[J]. 山东农业科学,2015,47(04):125-130.
[3]Jiangpei Han,Yihua Luo,Liping Yang,et al. Acidification and salinization of soils with different initial pH under greenhouse vegetable cultivation[J]. 2014,14(10):1683-1692.
[4]周鑫鑫. 设施农业肥料高投入对土壤环境次生盐渍化的影响研究[D]. 东华大学,2013.
[5]Ember M. Morrissey,Jaimie L. Gillespie,Joseph C. Morina,et al. Salinity affects microbial activity and soil organic matter content in tidal wetlands. 2014,20(4):1351-1362.
[6]柴晓彤. 微生物菌剂对盐渍化土壤改良研究[D]. 上海交通大学,2020.