1.上海工程技术大学 a.机械与汽车工程学院,上海 201620
摘要:很多心血管疾病与血管分叉处的血液流动异常有关。本文用DesignModeler进行建模并采用计算流体力学方法(Computational Fluid Dynamics,CFD) 对分叉血管内的血液流动进行求解。将血液视为非牛顿流体,研究血液在血管分叉部位的流动,讨论不同的粘度模型,入口流速以及血管的形态对于分叉血管内的血液流动速度分布、压力分布、壁面剪切应力的影响。研究结果表明低流速条件下,牛顿流体血液模型会大大低估壁面剪切应力,非牛顿血液粘度模型下的血流分布更为合理。入口速度越大或血管分叉角越大,分叉处的压力极值面积越大,血管壁容易因为极大的速度而被血流冲破造成损伤。在应对心血管疾病中,形成血栓和血管损伤与分叉血管的局部流动特点有密切联系。
关键词:Y型分叉血管;非牛顿;数值模拟;仿真结果
中图分类号:O357.1 文献标志码:A
1 引言
许多的研究表明,动脉粥样硬化、高血压、血栓、糖尿病等目前较为常见的心血管疾病的发病机理均与血管内的血液流动有关,包括血管表面的剪应力分布和速度分布等血液动力学因素血液流动方式会随着到血管几何形态(如血管弯曲、分叉、狭窄及汇交)的变化而随之发生改变,大量的临床实例表明血管病变多发于动脉血管分叉处。动脉血栓多发于大中动脉及血管的分支、分叉处。研究表明这些局部位置的流动通常表现为高剪切应力、扰动、流体分离和涡流等特征[1]。而动脉粥样硬化多发于分支血管外侧血管壁的低剪切应力区,随着动脉硬化病变的发展以及脂肪的堆积,进一步发生动脉狭窄。由此可见,对血管分叉处局部的血液动力学环境的深入分析对于我们认识这些心血管疾病的发病机理以及对医学诊断和临床治疗会提供重要的帮助。本研究基于CFD的数值模拟方法,研究分叉血管内血液的流动特性与血管的形态(血管分叉角度、分支管的对称性)之间的关系,进一步研究血液的非牛顿特性对于分叉血管处血液流动的影响。
2 数学模型与控制方程
2.1 数学模型的建立
采用ANSYS自带的DesignModeler建立三维T型分叉血管的几何模型,左侧为血流入口,上侧和右侧两个分支管均为血流出口。导入Meshing进行网格划分,并对出入口进行膨胀处理。
将T型血管认定为特殊的Y型分叉血管,其分叉角为90度。进一步依次建立分叉角为30度、60度以及对称分叉60度的Y型血管模型并进行网格划分。
2.2 控制方程的选取
2.2.2 研究方法与数学模型
本课题拟采用基于有限体积法的商用软件Fluent对分叉血管内的血液流动进行求解,假设血液是各向同性、不可压缩,在恒定温度下具有相同密度,血液的密度为1055 [2],并假设血管是刚性,不可渗透的,流动为层流。基于上述假设,血液流动的控制方程如下:
[2],并假设血管是刚性,不可渗透的,流动为层流。基于上述假设,血液流动的控制方程如下:
质量守恒方程:
 ···········(1)
···········(1)
动量守恒方程:
 ···(2)
···(2)
式中,U为血液流动的速度矢量,ρ为密度,p为压强, 为应力张量。
为应力张量。
对于牛顿型血液流动采用层流模型,血液密度为1055 ,血液粘度为
,血液粘度为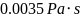 [3]。入口边界条件采用入口流速,出口采用出流边界条件。
[3]。入口边界条件采用入口流速,出口采用出流边界条件。
而非牛顿型血液可采用几种比较常用的模型进行对比,包含以下几种模型:
首先采用fluent中自带的非牛顿幂律模型[4]:
 ····(3)
····(3)
其中, 、
、 、
、 、
、 、
、
近些年血液流动数值计算中广泛采用的Carreau-Yasuda模型[5]:
 ···(4)
···(4)
上式中,γ为剪变率,其他参数的取值参考了相关文献种的实验测量结果:
本模型未包含在Fluent软件中,可利用基于C语言的用户自定义函数来定义血液的非牛顿流模型,在数值模拟计算时调用该模型实现非牛顿流动的模拟。
结合以上几种血液流体粘度模型对分叉管内血液流动进行模拟,研究血管的形态(分叉角度及分支管的对称性)以及入口速度对于血液在血管分叉处的流动的影响。
3 血液的非牛顿特性的影响
将血液视为牛顿流体,分析血管分叉处的血液流动特性,如流场分布、剪切应力分布等,然后选用不同的非牛顿流体模型模拟血液流动,研究血液的流动特点,并与牛顿流体在血流速度、血管壁面压力和剪切应力分布上进行对比。
当入口血流速度相同时,牛顿血液粘度模型血液流动最大速度均大于非牛顿血液粘度模型,血流速度极大值区面积大于非牛顿血液粘度模型。相比于牛顿血液模型,非牛顿血液模型下游区域处的低速涡流区增大,分支处的低速涡流区减小。随着入口血流速度的增大,非牛顿血液的速度极大值区域增大。且非牛顿流体下,涡流有层流的扰乱,分支管处的低速涡流区减小。相较于牛顿血液模型,非牛顿血液模型的血液流动在分叉交界处壁面剪应力突变的更明显。并且非牛顿血液模型下的壁面剪切应力大于牛顿血液模型下的值,其最大壁面剪切应力为4.47Pa,牛顿流的最大值为1.22Pa。可见,牛顿流与非牛顿流计算得到的血管内的血液流动的计算结果存在一定的差距,特别是壁面剪切应力的计算结果差距较大,将血液近似为牛顿流体在低速条件下会大大低估壁面剪切应力,特别是分叉交界处的壁面剪切应力。因此,在低流速条件下为了提高血管内血液流动计算结果的精确度,应采用适当的非牛顿流粘性模型。
4 模拟结果及分析
本课题基于Fluent软件模拟血液在分叉血管内的流动,首先选用不同的非牛顿流体模型,对比牛顿血液在分离点处的流动特点存在哪些不同,然后研究入口流速对于血液动力特性的影响,最后研究血管的形态变化(包括分叉角及分支管对称性)对于血液流动速度分布的影响。
4.1 Y型分叉血管分支管不同位置处的血流速度分布
本节研究分叉角为60°的Y型分叉血管内的血液流动(画出示意图,如图所示),血液粘度模型为Carreau-Yasuda模型。与T型管内的血液流动相似,在分叉上游区域速度出现极大值,在分支管以及分叉下游区域存在一低速区域,如图1所示。
 图1 Y型分叉血管(60度)的速度矢量图
图1 Y型分叉血管(60度)的速度矢量图
在分支管处有面积较大的低速涡流区域,流速在横截面上的分布呈现不对称性。
在分支管的右下侧,根据流动连续性,左上侧低速涡流区回流的出现,使得右下侧的速度较大,并且速度梯度较大;而在分支管的左上侧,低速涡流区的出现使得速度梯度较小,速度曲线的斜率趋于平缓。随着血液逐渐离开涡流区,血流速度分布逐渐趋于平缓,血流的速度峰值也逐渐下降,并最终呈现抛物线型分布,如图2。

图2 不同位置下的血流速度分布图
4.2 粘度模型对Y型分叉血管内血液流动的影响

因为低速情况下的血液非牛顿特性更为明显,所以控制入口血流速度为0.05m/s,血管模型为Y型分叉血管,其分叉角为60度,分析了分支管最大涡流处截面上的速度矢量分布。如图3所示,血液在流经支管的低速涡流区时会同时在内部产生一个二次涡流区。其中幂律模型和Carreau-Yasuda模型的二次涡流较为明显而牛顿流体情况下则几乎观察不到二次涡流。由于入口流速和血管的形态相同,血液在最大涡流处达到速度峰值的位置也几乎相同,相比于牛顿血液模型,非牛顿血液在分支管上的速度因为粘度增大,速度峰值下降,如图4。
 图4 不同粘度模型下的分支管低速涡流区截面上的血流速度分布图
图4 不同粘度模型下的分支管低速涡流区截面上的血流速度分布图
4.3 入口流速对血液流动的影响
进一步研究分叉角为60°的Y型分叉血管内入口流速对于血液流动的影响,控制血液粘度模型为Carreau -Yasuda模型,计算入口速度在0.1m/s-0.6m/s内的血液流动,得到以下速度云图和压力云图,如图5。由速度云图可知,在血液流经血管分支管前,血液速度的峰值处于血管的中轴线区域。而在流经分支管交叉处时,在分叉支管以及直通管下游区域出现了明显的低速涡流区,且随着入口流速的逐渐增大,低速涡流区的面积也逐渐增大。由压力云图可知,涡流区的压力较小,而在分叉支管与直通管交界处的管壁会形成一个压力的极大值,且随着入口速度越大,低速涡流区越大,压力出现极值的区域越大。在血流位置为最大涡流处比较不同血液进口流速的速度分布图。如图6所示,随着入口速度的增大,血液在分叉支管上的速度分布也更不对称,血流速度峰值出现的位置更加偏离管道中心。涡流的出现使得分支管处的最大速度比入口的血流速度大,且随着入口速度的增大,这种趋势也越明显。因此,入口血流速度越大,血管的分叉处的压力越大,且出现血液流动分离,使得分叉处更容易被冲刷以至于造成损伤。
 图6 不同入口流速下的分支管处截面上的血流速度分布图
图6 不同入口流速下的分支管处截面上的血流速度分布图
4.4 血管的形态(分叉角及分支管对称性)对血液流动的影响
为了研究分叉角度以及分支管的对称性对分叉血管内血液流动的影响,模拟了分叉角度为30°、60°以及90°的分叉管中分支处的横截面上的速度分布。如图7所示,血管分叉角越大,分支管的低速涡流区域面积越小,血液在涡流处的速度最大值就越小,速度分布更为平缓。对比前半段的速度分布可知,分叉角越大血流速度就越大,而在后半段血液也更快趋于稳定。在相同初始条件下,对比同样分叉角为60度的对称和非对称的模型,对称的血管前半段比非对称的血流速度大,而在后半段相对于非对称的模型较难趋于稳定。因此,在应对心血管疾病中,分叉角较大的血管更容易形成血栓,而分叉角较小的血管的血管壁容易因为极大的速度而被血流冲破。
相对于非对称的血管而言,对称的血管通过粘性流体的冲刷,在血管分叉处形成了一个低速度、高压力、高壁面剪切应力的区域。且由于血流速度在该处突然改变方向,额外施加给分叉处血管内壁面一个较大的压力,约有50Pa左右的压力差值,容易损伤血管。
 图7 不同血管形态下的血流速度分布图
图7 不同血管形态下的血流速度分布图
5 结论
本文采用了CFD数值模拟的方法研究了三维分叉血管内非牛顿血液流动情况。从粘度模型、入口流速、不同位置以及血管的形态入手,分析了对速度分布、压力分布、壁面剪切应力的影响。研究结果表明:
(1)在低流速条件下,牛顿血液模型会大大低估壁面剪切应力,而选择非牛顿血液粘度模型使得血流分布更为合理。
(2)入口速度越大,低速涡流区越大,压力出现极值的区域越大,血管的分叉血管更容易在涡流区被冲刷以至于造成损伤。
(3)在应对心血管疾病中,分叉角较大的血管更容易形成血栓,而分叉角较小的血管的血管壁容易因为极大的速度而被血流冲破。对称的血管相对于非对称而言由于血流速度在该处突然改变方向,额外施加给分叉处血管内壁面一个较大的压力,更容易损伤血管。
参考文献:
[1](美)钱德兰,(美)里特杰斯,(美)尤甘纳坦编著.生物流体力学 人体循环系统[M].北京:机械工业出版社.2015.
[2] Biasetti J, Hussain F, Gasser T, Charm et al. Blood flow and coherent vortices in the normal and aneurysmatic aortas: a fluid dynamical approach to intra-luminal thrombus formation [J]. J R Soc Interface, 2011, 8(63): 1449-1461.
[3] LIU Guo-tao (刘国涛), WANG Xian-ju (王先菊), AI Bao-quan (艾保全), et al. The advance of blood flow in complicated artery (复杂动脉血管内血液流动的研究进展) [J]. Chinese Journal of Medial Physics (中国医学物理学杂志), 2003, 20(3): 168-171.
[4] Sharma K, Khat S V. Non-Newtonian rheology of leukemic blood and plasma: are n and k parameters of power law model diagnostic [J]. Physiol Chem Phys Med NMR, 1992, 24(4): 307-312.
[5]熊丽丽,马怀安.三维复杂血管内非牛顿血液流动数值模拟[J].中国医药导刊,2011,13(02):303-304+306.
[6] 高巍. 血流动力学数值计算与模拟[D].中国科学技术大学,2009.
基金项目:上海工程技术大学校大学生科技创新项目(项目编号:CX2101026),上海市科技英才项目“扬帆计划”(项目编号:19YF1417400),国家自然科学基金项目(项目编号:11902188)
作者简介:位彦明(2000-),男,在读本科生,研究方向为CFD数值模拟,E-mail: weiyanming001204@163.com
通讯作者:肖兰兰(1987-),女,讲师,博士,研究方向为微流体,E-mail: xiaoll_sues@sues.edu.cn