海南海灵化学制药有限公司, 海南 海口 570311
摘要:药物临床试验是保证药品安全的关键环节。现阶段我国药物临床试验责任体系不够完善,对药物临床试验各参与方的责任进行详细分化,是保证药物临床试验规范、药品安全、药品创新的重点,也是维护受试者安全与权益的基础保障。本文主要从研究者、申办者和药品监督管理部分的责任问题进行研究,并提出完善我国药物临床试验责任体系的有效对策。
关键词:药物临床试验;问题分析;对策研究
药物临床试验质量管理规范是我国药品监督管理部门,为临床试验制定的标准化和规范化的质量标准,主要是为了确保临床药物试验结果的科学性与合理性,对受试者权益与安全进行保护。现阶段各国都需要根据国际法规和国家实际情况,制定药物临床试验基本法规,确保临床试验安全、有效、规范进行。在我国药物临床试验过程所遵守的法规中依旧存在一定问题,在今后药物临床试验中需要加强对问题的解决,更好地为药物的安全性提供保障。
1、药物临床试验中出现的责任缺失问题
1.1研究者责任缺失
近年来,随着药物临床研究项目日益增长,研究工作也越来越繁忙,研究人员在研究上问题不断地凸显出来,如在临床研究上缺乏临床研究的的基本素质、对研究团队的管理不足、对伦理审查流程的了解不足、对临床试验质量把控不足等问题的暴露。也有研究人员为了能够获得更加有效的临床试验数据,经常会出现违背试验方案和给药方案的情况,如擅自减少或加大试验药物的剂量、扩大样本量及不按入选/排除标准纳入受试者,以此来彰显新药品临床试验效果。为保障自身利益或名誉,研究人员在临床试验中,经常会采取各种不同的措施,来对临床试验结果进行控制,以使试验结果与预期效果相符。另外,研究人员经常会以筛选的方式来选择自身较为满意的数据结果,将满意的数据结果与较差的数据结果进行对比,以此来获取较好的临床试验结论。当试验数据结果不理想的时候,就会尝试着对数据结果进行修改,这样不仅得不到有效的临床试验结论,还会对后续的试验造成影响,对药品的安全性产生严重影响,甚至对试验中受试者造成重大的风险。
1.2申办者责任缺失
申办者作为药物临床试验的首要责任人,也是负责临床试验的发起、管理和提供临床试验经费的个人、组织或者机构,需要对药物临床试验进行全面的监督和管理,对风险进行预防,加强防控制度和处理报告程序的有效落实。但是在现阶段的药物临床试验方案中,对 的风险预判、防控制度、处理措施及报告程序的描述过于笼统,对建立临床试验的质量管理体系不够完善,对接受药物试验的受试者的安全造成潜在影响,增加了药物临床试验的风险。同时,申办者作为项目质量监督管理人员,自身的专业知识和技术能力不足,也会导致监督管理工作的质量受影响。缺少系统性的相关法律法规的培训,导致申办者对药物临床试验的掌握不够全面,对自身的职责认识较为模糊,无法确保整个临床试验中受试者的权益与安全及试验结果的可靠性。
的风险预判、防控制度、处理措施及报告程序的描述过于笼统,对建立临床试验的质量管理体系不够完善,对接受药物试验的受试者的安全造成潜在影响,增加了药物临床试验的风险。同时,申办者作为项目质量监督管理人员,自身的专业知识和技术能力不足,也会导致监督管理工作的质量受影响。缺少系统性的相关法律法规的培训,导致申办者对药物临床试验的掌握不够全面,对自身的职责认识较为模糊,无法确保整个临床试验中受试者的权益与安全及试验结果的可靠性。
1.3药物监督管理部门责任缺失
涉及药物临床试验参与者“职责”相关内容时,对责任的划分不够完善和明确,对 和
和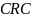 没有规范化的职责定义及责任分配。在药物临床试验中,合同研究组织主要是申办者的代表,在试验过程中承担或部分承担申办者的工作职责,
没有规范化的职责定义及责任分配。在药物临床试验中,合同研究组织主要是申办者的代表,在试验过程中承担或部分承担申办者的工作职责, 主要帮助研究人员承担部分研究者的职责,两者均属于商业组织。
主要帮助研究人员承担部分研究者的职责,两者均属于商业组织。 主要的业务就是委派
主要的业务就是委派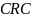 协助研究人员开展临床试验中非医学判断的相关工作,以此来保证临床试验按计划执行,确保临床试验过程能够与
协助研究人员开展临床试验中非医学判断的相关工作,以此来保证临床试验按计划执行,确保临床试验过程能够与 和研究方案中相关规定吻合。工作性质决定了
和研究方案中相关规定吻合。工作性质决定了 和派遣的
和派遣的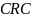 之间的关系,然而我国现阶段的
之间的关系,然而我国现阶段的 和
和 中都没有对
中都没有对 过多描述,对
过多描述,对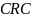 的责任也没有进行明确的划分。
的责任也没有进行明确的划分。
2、药物临床试验责任缺失的有效应对措施
2.1研究者责任缺失应对措施
研究者作为实施药物临床试验并对临床试验质量及受试者权益和安全负责的试验现场的负责人,多数情况都是临床医生,时间和精力都会受到限制,因此想要提升研究人员的依从性,就需要给研究人员适当的经济补偿,激励更多研究人员加入到药物临床试验当中并按GCP及研究方案中的要求执行。同时,也要加强研究人员的专业知识能力,以更好的提升药物临床试验的质量。此外,研究人员刻意的对试验数据进行筛选,也会对试验数据的科学性、有效性以及可靠性造成影响,但是现阶段很难控制研究人员对试验数据的筛选工作,所以需要加强对研究人员职业道德素养、法律法规和技术能力的培训,以此来加强研究人员的科学研究意识,保障试验数据结果的科学性和有效性。
2.2申办者责任缺失应对措施
申办者应建立整个临床试验过程中的全面质量管理体系,以发现并解决试验中存在的一系列质量问题,保证试验数据和结果科学、真实、可靠。也通过查阅国内外相关文献,参考前期临床试验经验,对可能出现的 进行风险预判,制定较为详细且可操作的防控机制和处理报告程序,并在药物临床试验方案中进行描述,以此来完善临床试验方案。这样不仅是对受试者书面形式的保证,还能够为
进行风险预判,制定较为详细且可操作的防控机制和处理报告程序,并在药物临床试验方案中进行描述,以此来完善临床试验方案。这样不仅是对受试者书面形式的保证,还能够为
 的防控和处理提供科学依据,降低药物临床试验过程中出现的安全风险和经济损失,提高了受试者的安全性。
的防控和处理提供科学依据,降低药物临床试验过程中出现的安全风险和经济损失,提高了受试者的安全性。
申办者可以委托有经验的CRO公司对临床试验进行监督和管理。在实际工作过程中,需要加强对监督人员的培训和教育,确保监督人员能够掌握临床试验的相关知识,在监督管理的过程中更加灵活地运用所学知识,加强监督管理执行的实际效果,进一步为药物临床试验的质量提供保障及保护受试者的权益与安全。
2.3药物监督管理部门应对措施
不断完善我国 ,明确划分
,明确划分 和
和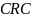 之间的职责。临床试验主要包括申办方和研究中心两个部分,随着我国药物临床试验不断完善,以提供临床监查人员为主的合同研究组织和以提供
之间的职责。临床试验主要包括申办方和研究中心两个部分,随着我国药物临床试验不断完善,以提供临床监查人员为主的合同研究组织和以提供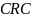 为主的
为主的 也将成为药物临床试验中不可或缺的关键部分。虽然并非所有药物临床试验都需要有两者的参与,但是其职责必需要在我国药物临床试验管理规范中进行补充和完善,以此来规范我国的药物临床试验,促进我国
也将成为药物临床试验中不可或缺的关键部分。虽然并非所有药物临床试验都需要有两者的参与,但是其职责必需要在我国药物临床试验管理规范中进行补充和完善,以此来规范我国的药物临床试验,促进我国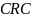 和
和 的发展。
的发展。
结束语:药物临床试验作为药品研发的重要环节,对受试者人身安全有着直接影响,因此需要加强对临床试验的重视程度。现阶段我国临床试验中存在较多的问题,比如相关的规定不够完善,日常缺少培训、监管体系不够全面等,从根本上来看,主要是因为我国缺少完善的药物临床试验责任体系,只有不断将责任体系进行完善,将试验过程中的责任落实到每一位参与者身上,建立能够落实到试验各个环节的责任体系制度内容,才能够不断完善临床试验的具体流程,真正对我国药物临床试验现状进行改善,提高我国药品的质量。
参考文献:
[1]高荣,宁靖,王安娜,方翔,张蓉.从药物临床试验数据核查看药物临床试验机构的职责履行情况[J].中国新药杂志,2019,28(20):2518-2523.
[2]高荣,吕术超,李秀丽,雷明武,钱雪.从药物临床试验数据核查看研究者的职责履行情况[J].中国新药杂志,2019,28(20):2508-2512.
[3]王兴娇,赵迎欢.我国药物临床试验安全责任分属、问题及应对措施[J].中国新药与临床杂志,2017,36(09):518-521.
[4]孙宇昕,魏芬芳,杨悦.美国药物临床试验法律责任研究[J].中国药物警戒,2017,14(07):424-429.
[5]柳正植,崔英子,齐彩缤,刘柳,杨海淼.多中心药物临床试验中牵头单位的职责[J].长春中医药大学学报,2016,32(04):844-846.
[6]董晓峰,范贞.药物临床试验责任保险保障案例的分析[J].中国临床药理学杂志,2015,31(24):2474-2476.