浙江省诸暨中学暨阳分校
高三年级的选考模拟考试,学校已经组织了好几次了,我任教的班级,学生基础本身就差,学生考试的成绩一直不理想,特别是填空题,总分50分,学生的平均得分基本上都在10分到11分之间,第30题是实验综合大题,学生的平均得分,也就在2分左右,我研究了浙江省选考以来的10次考试,发现实验大题有9次是考无机物的制备,而且考点基本上还是比较集中的,我觉得可以编一个大的无机制备实验综合大题,把选考出现频率较高的知识点都编进去,而且把答题要点和学生强调清楚,我觉得这样复习,应该能够提高学生的成绩。下面我以2016年10月的浙江选考化学试卷第31题为模板,改编一个大的实验综合大题,并结合题目和选考实验综合大题考点的统计情况,进行实验大题的复习。
31.某研究小组在实验室以含铁的铜屑为原料制备Cu(NO3)2·3H2O晶体,并进一步探究用SOCl2制备少量无水Cu(NO3)2。设计的合成路线如下:
![]()
已知:Cu(NO3)2·3H2O——→Cu(NO3)2·Cu(OH)2——→CuO
SOCl2熔点一105℃、沸点76℃、遇水剧烈水解生成两种酸性气体。
金属离子形成氢氧化物沉淀的pH范围
金属离子 | 开始沉淀的pH | 完全沉淀的pH |
Cu2+ | 5.2 | 6.4 |
Fe2+ | 5.5 | 8.3 |
Fe3+ | 1.1 | 2.8 |
请回答:
(1)第①步加入过量稀硝酸的原因是__________。
(2) 第②步调pH适合的物质是_____(填化学式),合适的pH范围是_____。
(3)第④步包括蒸发浓缩、冷却结晶、抽滤等步骤,其中蒸发浓缩的具体操作是_______,为得到较大颗粒的Cu(NO3)2·3H2O晶体,可采用的方法是___________(填一种)。
有关抽滤,下列说法正确的是 。
A.滤纸应比漏斗内径略小,且能盖住所有小孔
B.图1抽滤装置中只有一处错误,即漏斗颈口斜面没有对着吸滤瓶的支管口
C.先转移溶液至漏斗,待溶液快流尽时再转移沉淀
D.洗涤沉淀时,应使洗涤剂快速通过沉淀
E.抽滤得到的滤液应从吸滤瓶的支管口倒出
F.抽滤完毕后,应先拆下连接抽气泵和吸滤瓶的橡皮管,再关水龙头,以防倒吸
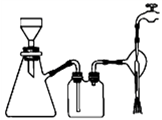
图1
(4)步骤③和④中包含抽滤,抽滤过程中要洗涤沉淀,分析泽两次洗涤的不同目的__________________________________________________________
(5)第⑤步中发生反应的化学方程式是______________________。
(6)第⑤步,某同学设计的实验装置示意图(夹持及控温装置省略,如图2),图中仪器B的名称是_________,作用是__________________________,该装置图中有一处不合理,请提出改进方案并说明理由______________。
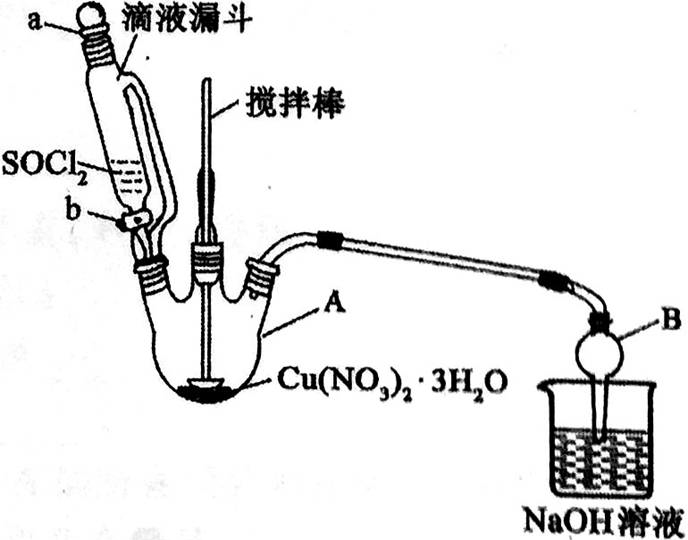
图2
装置改进后,向仪器A中缓慢滴加SOCl2时,需打开活塞______(填“a”、‘‘b”或“a和b”)。
(7)间接碘量法测定无水Cu(NO3)2纯度的原理和方法如下:
在弱酸性条件下,Cu2+与I-反应:2Cu2+ + 4I- = 2CuI↓ + I2 ,生成的 I 2 可用Na2S2O 3 标准溶液滴定:2S 2O32- +I2 ===S4O62- +2I-。
操作:准确称取a g无水Cu(NO3)2试样,置于250 mL碘量瓶(带磨口塞的锥形瓶)中,加50 mL蒸馏水、5 mL 3 mol/L H2SO 4 溶液,再加入足量的10%KI溶液,摇匀.盖上碘量瓶瓶盖,置于暗处5 min,充分反应后,加入1-2 mL 0 . 5%的淀粉溶液,用Na2S2O3 标准溶液滴定到蓝色褪去时,共用去V mL标准液。
①滴定前,有关滴定管的正确操作为(选出正确操作并按序排列):
检漏→蒸馏水洗涤→(____)→(____)→(____)→(____)→(____)→开始滴定。
A.烘干 B.装入滴定液至零刻度以上
C.调整滴定液液面至零刻度或零刻度以下
D.用洗耳球吹出润洗液 E.排除气泡
F.用滴定液润洗2至3次 G.记录起始读数
②滴定法测得产品中无水Cu(NO3)2含量远远超过100%,请你分析造成这样的结果的原因是_____________________。
【答案】
(1)保证将Fe氧化成Fe3+,便于后续的除杂过程,同时可以加快化学反应速率
(2)CuO或Cu(OH)2或CuCO3或Cu2(OH)2 CO32.8~5.2
(3)将溶液转移到蒸发皿中,控制温度加热至溶液表面出现一层晶膜
减慢冷却结晶的速度 ACF
(4)第③步洗涤的目的是将沉淀表面的Cu(NO3)2洗下来,减少Cu(NO3)2的损失 第④步洗涤的目的是,除去晶体表面的可溶性杂质
(5)Cu(NO3)2·3H2O + 3SOCl2 == Cu(NO3)2 + 3SO2↑ + 6HCl↑
(6)干燥管 防止倒吸
在A、B之间加一个干燥装置,防止B中的水蒸气进入反应器A中
b
(7)FBECG
Cu(NO3)2中加入H 2 SO 4 溶液和KI溶液后,NO3-和H+,I-反应,会生成I2,造成实验结果偏大
结合上面的题目,进行实验化学考试重点的复习,主要是以下内容:
(1)化学试剂的考察,是实验综合大题的重点,9次考试,总共考了6次,主要是试剂的作用,选择某种试剂的原因,加入过量的试剂,一般目的是两个,一是保证另一种反应物的充分反应,二是加快化学反应。
(2)调节pH值,属于反应条件控制,总共考了2次,一般都是为了调节pH值,除去某些金属阳离子,所加的试剂一般要考虑不能引入杂质,比如本题中,加入的物质是可以与H+反应,而生成的离子是溶液本身含有的非杂质离子Cu2+。其它的除杂过程,原理也是一样的,可以出去杂质,又不引人新的杂质。
(3)无机制备实验大题中,制取后分离得到产品,一般的操作都是蒸发浓缩、冷却结晶、抽滤,洗涤、干燥,其中抽滤又是重点中的重点,总共考了6次,其中2次是以选择题的形式考察,总结历次考试以后发现,实验化学教材P14-15的减压过滤操作向导,里面的每一条都考过了,所以定一要让学生牢牢的掌握这个知识点。
通过减慢冷却结晶的速度得到较大颗粒的晶体,属于条件控制,这个知识点也是重点,在9次考试中,考了5次,也是重点中的重点。
(4)洗涤也是制备大题的重点,主要是洗涤的目的和洗涤剂的选择,总共考查了4次,洗涤的目的分两种情况,若滤液是所需的物质,洗涤的目的是洗涤过滤所得的滤渣,把有用的物质如目标产物尽可能洗出来;若滤渣是所需的物质,洗涤的目的是除去晶体表面的可溶性杂质,得到更纯净的沉淀物。洗涤剂的选择要求是两条,一是洗去杂质,二是尽量减少产品的溶解。
(5)化学方程式的考察也是重点,9次考试,总共考了6个方程式,有些方程式是教材里有的,教材里没有的方程式,题目一般都会给一些信息,常见的是氧化还原反应的方程式,根据氧化还原反应的基本规律来写方程式。
(6)实验装置的考查也是重点中的重点,制备时的仪器,最常用的是三颈烧瓶,9次考试出现了5次(在28题也出现了2次),其次是滴液漏斗,出现了3次(在28题也出现了2次),抽滤装置也出现了2次,对于常见的实验装置,要有所了解,对于常见仪器的用途,要掌握好。
(7)产品纯度的测定或者产品中杂质的检验,也是考查重点,9次考试出现了5次,测定纯度首先要搞清楚测定的原理,比如,本题中,根据信息,可得出2Cu2+~ I2 ~ 2S 2O32-,即Cu(NO3)2与Na2S2O 3的物质的量相同。本题中涉及的滴定操作也是实验考查的重点,9次考试出现了4次,而且两次是排序,所示滴定操作的顺序也是要弄清楚的。
上述题目,基本上已经包含了实验综合大题绝大部分的考察重点,学生如果能够掌握好这些知识点,应该可以提高实验综合大题的得分率。